Как рисовать резонансные структуры
Мы можем нарисовать две или более структур Льюиса для некоторых молекул и многоатомных ионов, не меняя положения атомов в структуре. В этом случае только электронное распределение отличается от одной
Содержание:
Что такое резонансная структура
Мы можем нарисовать две или более структур Льюиса для некоторых молекул и многоатомных ионов, не меняя положения атомов в структуре. В этом случае только электронное распределение отличается от одной структуры к другой. Эти структуры называются резонансные структуры или же содействующие структуры. Но фактическая молекула имеет промежуточную структуру из этих возможных структур Льюиса.
Первый шаг рисования резонансных структур начинается с рисования всех возможных структур Льюиса. Если у него только одна структура Льюиса, у него нет резонансного гибрида.
Как определить молекулы, имеющие резонанс
Резонанс существует только тогда, когда структура Льюиса имеет несколько связей и соседний атом, по крайней мере, с одной неподеленной парой. Общая форма резонанса иллюстрируется ниже. Стрелки используются для обозначения смещения электронов из одной резонансной структуры в другую.
Как рисовать резонансные структуры
Структуры Льюиса
Пример 1: СО3 2- ион
Шаг 1
Рассчитайте общее количество валентных электронов от каждого атома.
Атомы кислорода (3 * 6) = 18
Шаг 2
Когда имеется более одного типа атомов, оставьте наименьший электроотрицательный или металлический атом в качестве центрального атома.
Углерод является центральным атомом в СО3 2- ион
Шаг 3
Объедините каждый атом с единственной связью с центральным атомом, внося один электрон от каждого атома для связи.
Шаг 4
Подсчитайте электроны в валентной оболочке, чтобы проверить, завершен ли октет.
Атому углерода нужен еще один электрон, а каждому атому кислорода нужен еще один электрон, чтобы завершить октет.
Шаг 5
Если нет, добавьте еще несколько связей, пока все октеты не будут заполнены.
** Оставьте несвязанные электроны в виде точек и нарисуйте одну линию (-) для одинарной связи и две линии (=) для двойной связи.
Если мы добавим одну связь между атомом углерода и атомом кислорода, то и атом углерода, и атом кислорода завершат октет.
Шаг 6
Окончательная структура может быть записана следующим образом.
Шаг 7
Теперь мы можем нарисовать возможные резонансные структуры, как обсуждалось в разделе 1.
Мы можем нарисовать три резонансные структуры для СО3 2- ион, как указано выше.
Давайте возьмем еще два примера, чтобы научиться рисовать резонансные структуры.
Пример 2: O3 молекула
Мы можем использовать ту же процедуру, что описана выше, чтобы получить структуру Льюиса. Это дает следующую структуру, и имеет несколько связей и соседний атом с одной неподеленной парой электронов.
Таким образом, мы можем нарисовать резонансные структуры для O3 Молекула следующим образом.
Пример 3: Карбоновая кислота
Мы можем получить следующие резонансные структуры, выполнив те же шаги, что и упомянутые выше.
Структура Льюиса: простой метод представления конфигурации атомов в молекуле, показывающий неподеленные пары электронов и связи между атомами.
Написание резонансных структур. (Н.о.). Получено 15 ноября 2016 г.
Как написать резонансные структуры
Если с индуктивным эффектом обычно проблем не бывает, то второй тип электронных эффектов гораздо труднее поддается освоению. Это очень плохо. Теория резонанса (мезомерия) была и остается одним из важнейших инструментов обсуждения структуры и реакционной способности органических соединений и заменить ее нечем. А как же квантовая наука?! Да, правда, в нашем веке стали легкодоступными квантово-химические расчеты, и теперь каждый исследователь или даже студент, потратив весьма немного времени и сил, может бесплатно раскочегарить на своем компьютере расчеты, уровню которых еще 20 лет назад позавидовали бы все нобелевские лауреаты. Увы, результаты расчетов не так просто использовать – они плохо поддаются качественному анализу и зрительно не очень понятны. Сидеть и смотреть на бесконечные столбики цифр и рассматривать запутанные и перегруженные картинки орбиталей и электронной плотности можно долго, но пользу из этого извлекают немногие. Старая добрая теория резонанса в этом смысле гораздо эффективнее – она быстро и довольно надежно дает именно качественный результат, позволяет видеть, как распределена электронная плотность в молекуле, найти реакционные центры, оценить устойчивость важных частиц, участвующих в реакциях. Поэтому без умения нарисовать резонансные структуры, оценить их вклад, и понять, на что влияет делокализация, никакой разговор об органической химии невозможен.
Есть ли разница между понятиями мезомерии и резонанса? Была когда-то, но уже давно не имеет значения – сейчас это интересно только историкам химии. Будем считать, что эти понятия взаимозаменимы, можно использовать какое-то одно или оба в любых пропорциях. Один нюанс есть – когда говорят не о делокализации в общем, а об электронном эффекте заместителя, предпочитают термин мезомерный эффект (и обозначают соответственно буквой M). Кроме того, еще используют и слово “сопряжение” (точнее, π-сопряжение).
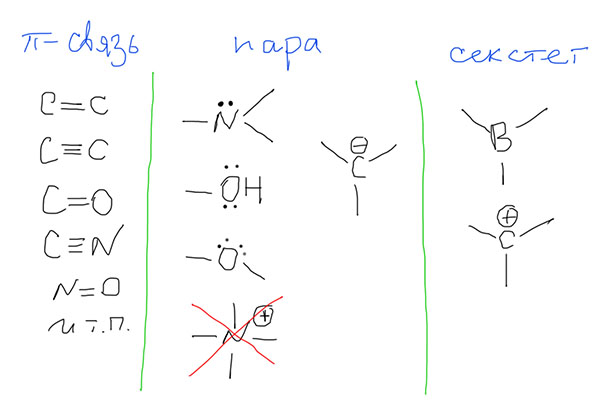
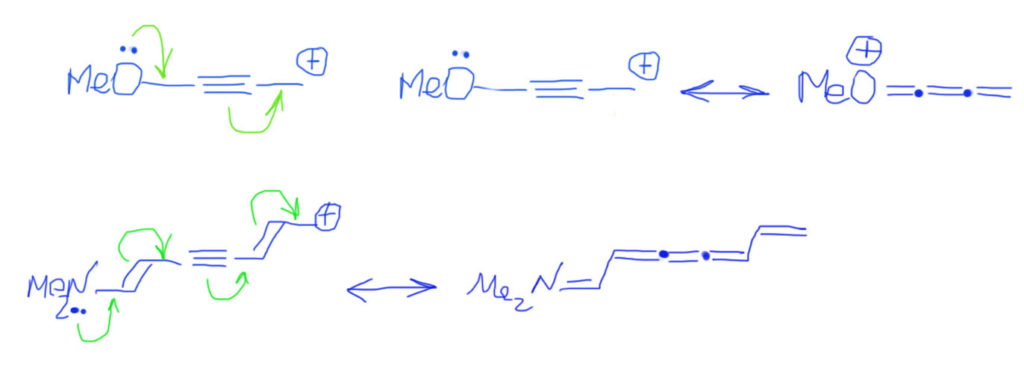
И когда возникает эта мезомерия? Это понятие применимо только к π-электронам и только в том случае, если в молекуле есть хотя бы два атома с такими электронами, расположенные рядом. Атомов таких может быть сколько угодно, хоть миллион, и расположены они могут быть не только линейно, но и с любыми разветвлениями. Необходимо только одно – чтобы они были рядом, образовывали неразрывную последовательность. Если последовательность линейна, она называется “цепью сопряжения”. Если разветвлена, это усложняет дело, так как возникает не одна цепь сопряжения, а несколько (это называется кросс-сопряжение), но на этом этапе про это можно не думать, мы не будем внимательно рассматривать такие системы. Важно, что любой атом без π-электронов прерывает такую последовательность (цепь сопряжения), или разрывает ее на несколько независимых.
На каких атомах есть π-электроны?
Кроме этого в сопряжении участвуют пустые π-орбитали в атомах с 6-ю валентными электронами (секстетных атомах): бора, углерода с положительным зарядом (в карбениевых ионах), а также аналогичных частицах с атомами азота, кислорода (это пока отложим в сторону). Договоримся пока не трогать элементы третьего и т.д. периодов, даже серу и фосфор, потому что для них нужно учитывать участие d-оболочек и не работает правило октета Льюиса. Корректно рисовать граничные структуры для молекул с участием этих элементов не так просто, но нам это, скорее всего, и не понадобится. Если понадобится, рассмотрим отдельно.
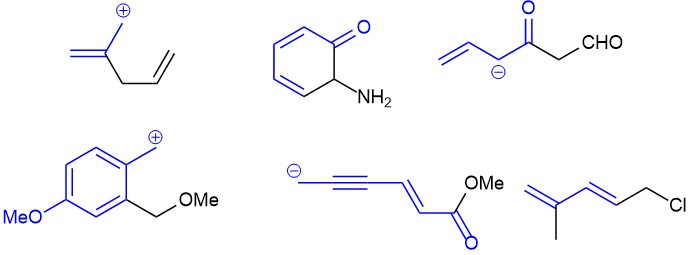
Поищем сопряженные фрагменты в реальных молекулах. Все просто – находим кратные связи, атомы с парами и секстетные атомы, находящиеся рядом друг с другом в любых (пока) комбинациях. Важно, что наблюдатель, идущий по цепи сопряжения, не должен наступать на атомы, не принадлежащие к этим трем типам. Как только встречаем такой атом, цепь заканчивается.
Теперь посмотрим на то, как это изображать. Изображать будем двумя способами – стрелками смещения электронной плотности и резонансными (граничными) структурами.
Тип 1. Находим в сопряженной системе донорные и акцепторные центры.
Тип 2. Кроме донора и акцептора еще и кратные связи.
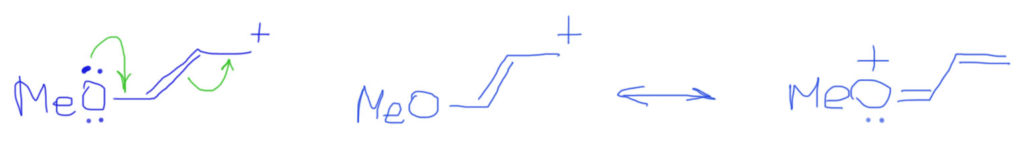
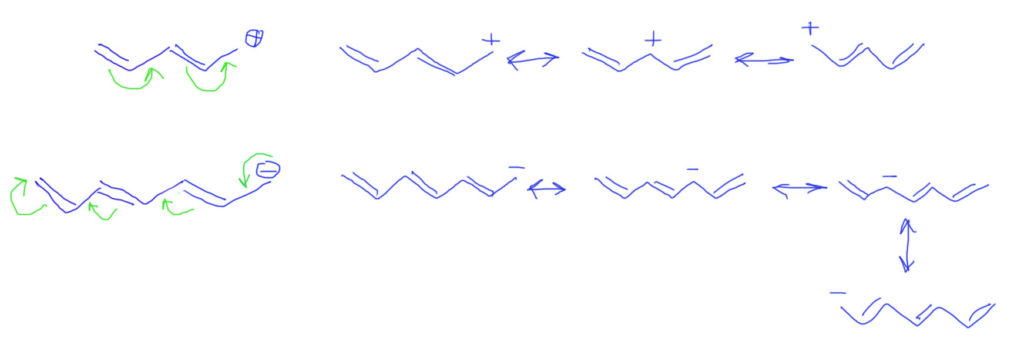
Если двойных связей не одна, а несколько, выстроенных в цепочку, то ситация усложняется не сильно. Стрелками показываем смещение плотности от пары, и последовательное смещение каждой двойной связи вплоть до заполнения секстета потребует дополнительных стрелок. Граничных структур по-прежнему две, и вновь вторая намного выгоднее и близко отражает реальную структуру катиона.
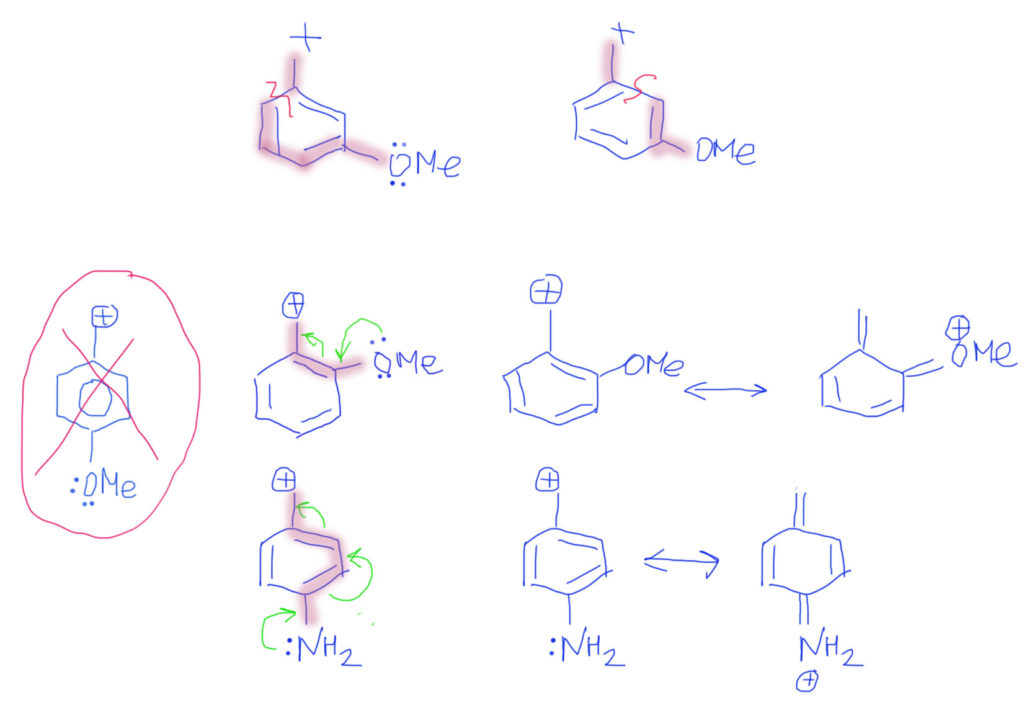
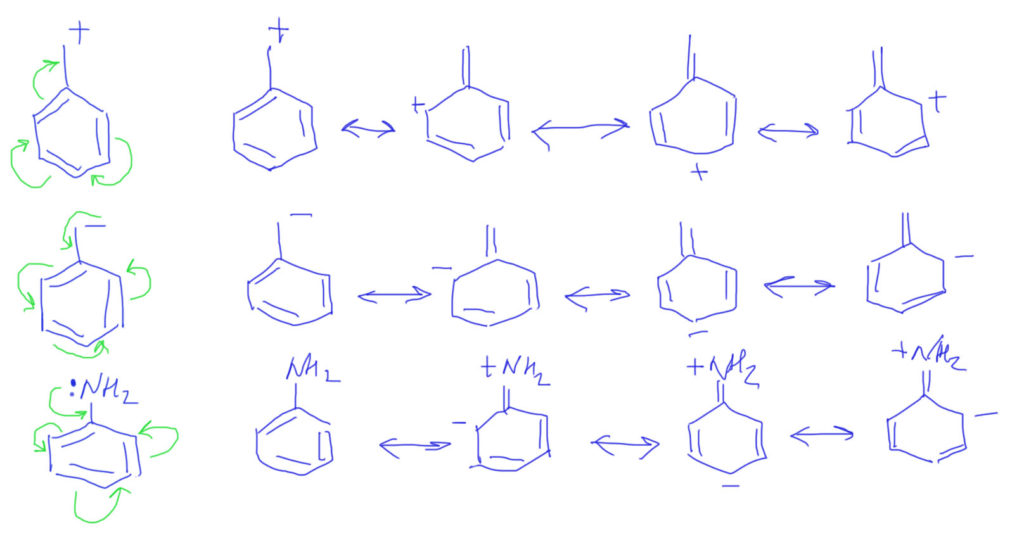
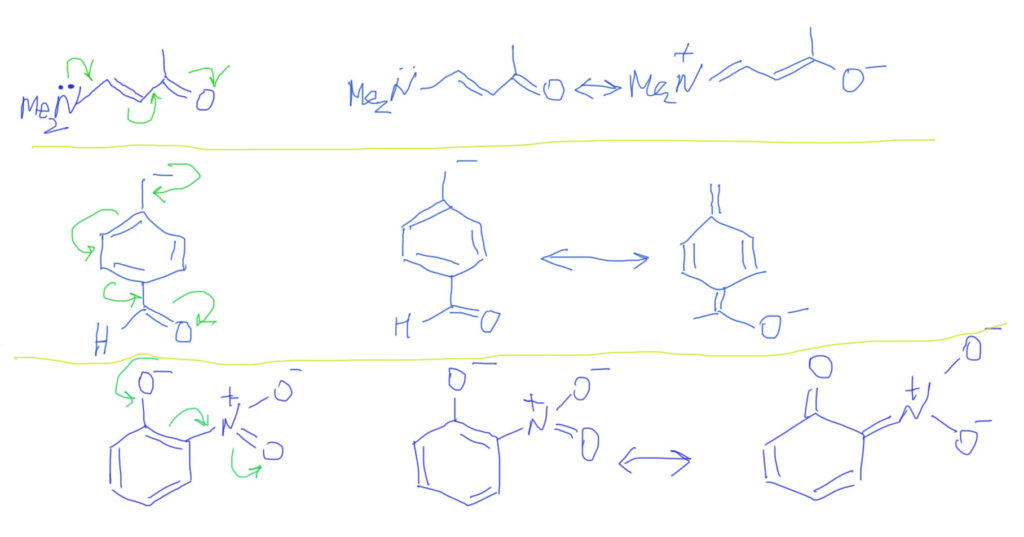
Случай, когда вместо обычных двойных связей бензольное кольцо, вполне вписывается в эту схему. Важно только рисовать бензольное кольцо не гайкой, а нормальной структурой Кекуле. С гайкой сопряжение изобразить не получится. Тогда мы сразу поймем две важные вещи: во-первых, что бензольное кольцо в делокализации работает как сопряженная система двойных связей и ни о какой ароматичности думать не нужно; во-вторых, что пара- и орто-расположение донора/акцептора сильно отличается от мета-расположения, в котором сопряжение отсутствует. На рисунках розовеньким напылением показаны пути сопряжения, и видно, что в орто-случае работает одна двойная связь, в пара-случае – две, а в мета-случае, как его ни нарисуй, путь сопряжения разрывается, и сопряжения нет.
Если попадаются не двойные, а тройные связи, то ничего не меняется. Нужно просто представить тройную связь как две взаимно перпендикулярные π-связи, и одну из них использовать, а вторую оставить в покое. Не пугайтесь – получается немного страшновато от обилия двойных связей в граничной структуре. Обратите внимание, что двойные связи на одном атоме углерода обозначают на прямой (так как этот атом углерода имеет sp-гибридизацию), и, чтобы не запутаться, обозначают эти атомы жирными точками.
Тип 3. В цепи сопряжения либо донор, либо акцептор (но не оба сразу), и кратные связи С=С или С≡С
Если кратных связей больше, действуем по аналогии, добавляем стрелки, вовлекая каждую кратную связь в делокализацию. А вот граничных структур нужно рисовать не две, а столько, сколько есть кратных связей в цепи плюс исходную. Видим, что заряд делокализуется по нечетным атомам. Реальная структура будет где-то посредине.
Обобщим на донор – атом без заряда, но с парой. Стрелки будут такие же, как в случае аллильного карбаниона. Граничные структуры формально тоже, но они в этом случае неравноценны. Структуры с зарядами гораздо менее выгодны чем нейтральные. Реальная структура молекулы ближе с исходной, но картина делокализации позволяет понять, почему на дальнем атоме углерода возникает избыточная электронная плотность.
Делокализация в бензольном кольце опять требует представления с двойными связями, и рисуется вполне аналогично. так как связи три и все они участвуют, то граничных структур будет, помимо исходной, еще три, а заряд (плотность) размажется по орто и пара положениям.
Тип 4. В цепи сопряжения донор и кратные связи, некоторые из которых содержат гетероатом (С=O, C=N, N=O и т.п.)
Итак, если есть донор и такая связь, то смещение плотности показать очень легко. Из двух граничных структур будет преобладать та, у которой заряд находится на более электроотрицательном атоме, впрочем, и роль второй структуры также всегда весьма существенна. Естественно, если случай симметричный, как тот, что показан на второй строчке, то обе структуры одинаковы и представлены поровну – реальная структура будет посредине точно так же, как в ранее рассмотренном случае аллильного аниона.
Если в молекуле или ионе есть еще и сопряженные углерод-углеродные связи, они будут скромно участвовать в общем смещении плотности. Такова же и роль бензольного кольца с орто- или пара-расположением донора и акцептора. Обратите внимание, что граничных структур всегда только две – они показывают два крайних положения для смещения плотности. Промежуточных структур (там, где плотность уже сместилась от донора на кратную связь, но дальше не прошла) рисовать не нужно. Вообще-то они есть и вполне законны, но их роль в делокализации пренебрежимо мала. Третий пример на представленной схеме показывает, как рисовать нитро-группу. Она поначалу пугает обилием зарядов, но если посмотреть на нее просто нак на двойную связь азот-кислород, то смещение рисуется точно так же, как и для любых других кратных связей с гетероатомами, а те заряды, которые там уже есть, нужно просто оставить в покое и не трогать.
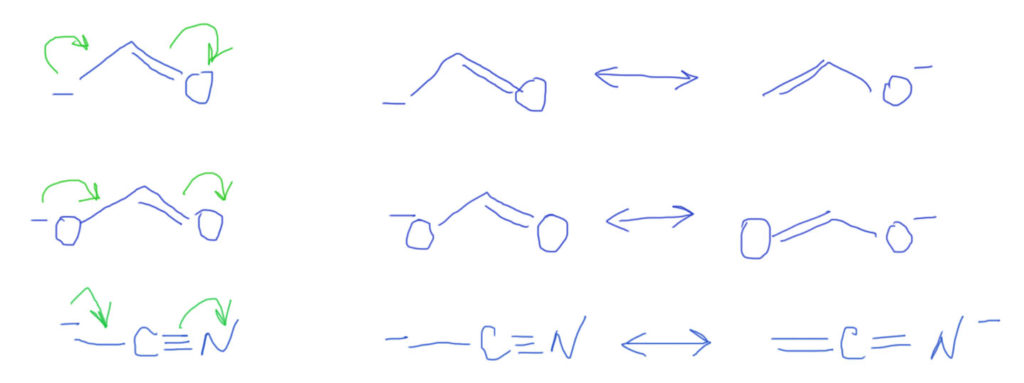
И еще один распространенный вариант – донор один, а акцепторных кратных связей несколько (две, три). Строго говоря, в этом случае не одна цепь сопряжения, а две, три. Это увеличивает число граничных структур, и также может быть показано стрелками, хотя этот способ не вполне корректен, так как от одной донорной пары будет несколько стрелок. На этом примере хорошо видно, что граничные структуры – более универсальный способ, хотя и более громоздкий.
Как написать резонансные структуры
Иногда можно записать несколько правильных формул Льюиса, которые различаются характером связей между одними и теми же атомами. Например:
В каждом случае существует два пути выполнения правила октета для всех атомов. Если молекулу можно представить двумя или более такими формулами, в которых атомы соединены в одной и той же последовательности, эти формулы называются резонансными формами или классическими резонансными структурами.
Резонансные структуры принято соединять обоюдоострыми стрелками, как это сделано выше.
Реальная структура частицы не совпадает ни с одной из резонансных структур. Не происходит и непрерьюного превращения одной структуры в другую и обратно. На самом деле истинная структура есть нечто среднее между двумя предельными формами. Эта реальная структура носит название резонансного гибрида.
В первом случае резонансный гибрид к первой структуре значительно ближе, чем ко второй. Однако реальная молекула имеет и некоторые черты второй структуры с зарядами на атомах азота и кислорода. В двух Других случаях обе предельные структуры вносят одинаковый вклад в резонансный гибрид. Кратность связей в обоих случаях равна 
Соединения, для которых возможны резонансные структуры, обычно более стабильны. Скажем, во втором примере отрицательный заряд распределен по двум атомам кислорода, а не сконцентрирован только на одном из них. Такая делокализация заряда является стабилизирующим фактором. В первом примере связь 
Вообще надо помнить, что польза любой теории определяется способностью этой теории объяснять уже известные факты и предсказывать новые.
Резонанс — это делокализация электронов внутри ковалентно связанной частицы, приводящая к дополнительной стабилизации этой частицы. Резонанс изображается с помощью резонансных структур, соединяемых обоюдоострыми стрелками или с помощью резонансных гибридов.
В химия, резонанс это способ описания связи в определенных молекулах или ионах комбинацией нескольких содействующие структуры (или же формы, [1] также известный как резонансные структуры или же канонические структуры) в резонансный гибрид (или же гибридная структура) в теория валентной связи. Он имеет особое значение для описания делокализованные электроны в пределах определенных молекулы или же многоатомные ионы где связь не может быть выражена одним единственным Структура Льюиса.
Содержание
Обзор
Резонансный гибрид представляет реальную молекулу как «среднее» из структур, способствующих, с длинами связей и частичные сборы принимая промежуточные значения по сравнению с ожидаемыми для отдельных структур Льюиса вкладчиков, если бы они существовали как «настоящие» химические образования. [3] Способствующие структуры различаются только формальный распределение электронов по атомам, а не в реальной физически и химически значимой электронной или спиновой плотности. Хотя структуры вкладчиков могут отличаться формальными поручениями на облигации и официальное обвинение задания, все участвующие структуры должны иметь одинаковое количество валентных электронов и одинаковый спин множественность. [4]
Поскольку делокализация электронов снижает потенциальную энергию системы, любой вид, представленный резонансным гибридом, более стабилен, чем любая из (гипотетических) структур, вносящих свой вклад. [5] Разница в потенциальной энергии между фактическими видами и (вычисленной) энергией вносящей вклад структуры с самой низкой потенциальной энергией называется резонансная энергия [6] или энергия делокализации. Величина резонансной энергии зависит от предположений, сделанных относительно гипотетических «нестабилизированных» частиц и используемых вычислительных методов, и не представляет собой измеримую физическую величину, хотя сравнения резонансных энергий, вычисленных при аналогичных предположениях и условиях, могут иметь химический смысл.
Молекулы с расширенной π-системой, такие как линейные полиены и полиароматические соединения, хорошо описываются резонансными гибридами, а также делокализованными орбиталями в теория молекулярных орбиталей.
Резонанс против изомерии
Резонанс следует отличать от изомерия. Изомеры представляют собой молекулы с одинаковой химической формулой, но представляют собой разные химические соединения с различным расположением атомных ядер в пространстве. С другой стороны, компоненты резонанса в молекуле могут различаться только способом, которым электроны формально приписываются атомам в структуре Льюиса. изображения молекулы. В частности, когда говорят, что молекулярная структура представлена резонансным гибридом, это нет означают, что электроны молекулы «резонируют» или перемещаются вперед и назад между несколькими наборами положений, каждое из которых представлено структурой Льюиса. Скорее это означает, что набор способствующих структур представляет собой промежуточную структуру (средневзвешенное значение участников) с единственной четко определенной геометрией и распределением электронов. Неверно рассматривать резонансные гибриды как быстро взаимопревращающие изомеры, даже если термин «резонанс» может вызвать такое представление. [7] (Как описано нижетермин «резонанс» возник как аналогия классической физики квантово-механического явления, поэтому его не следует толковать слишком буквально.) Символично, двунаправленная стрелка B>>>»> А ⟷ B < displaystyle < ce >> 

Из-за путаницы с физическим значением слова резонанс, поскольку на самом деле никакие объекты физически не «резонируют», было предложено отказаться от термина «резонанс» в пользу делокализация [8] и резонансной энергии отказались в пользу энергия делокализации. Резонансная структура становится способствующая структура и резонансный гибрид становится гибридная структура. Двуглавые стрелки будут заменены запятыми, чтобы проиллюстрировать набор структур, поскольку стрелки любого типа могут указывать начинающим студентам на то, что происходит химическое изменение.
ТЕОРИЯ РЕЗОНАНСА
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
Описание слайда:
Под термином «РЕЗОНАНС» следует понимать способ изображения молекулы, который применяется в том случае, когда для адекватного (точного) описания данного соединения не может быть использовано единственное электронное распределение.
ТЕОРИЯ РЕЗОНАНСА
В теории резонанса реальную молекулу представляют как гибрид структур, которые могут быть нарисованы, но сами по себе в действительности не существуют.
Эти гипотетические структуры называют РЕЗОНАНСНЫМИ (КАНОНИЧЕСКИМИ, ГРАНИЧНЫМИ) структурами.
Описание слайда:
Например: аллил-катион можно представить двумя резонансными структурами I и II:
ТЕОРИЯ РЕЗОНАНСА
Н2С=СН−СН2 ↔ Н2С−СН=СН2
+
+
1
2
3
1
2
3
Видно, что положительный заряд в аллил-катионе не является точно локализованным на одном каком то атоме углерода, а рассредоточен (делокализован) между двумя атомами:
Н2С СН СН2
+
I
II
Описание слайда:
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
1) Если молекула может быть представлена двумя или более структурами, отличающимся только распределе-нием электронов, т.е. структурами, в которых расположение атомных ядер одинаково, то становится возможным резонанс. Реальная молекула представляет собой гибрид этих граничных (канонических) структур и не может быть удовлетворительно представлена ни одной из них.
2) Хотя каждая из структур вносит свой вклад в гибрид наибольший вклад (наилучшее приближение к гибриду) дают структуры с наименьшей энергией (более устойчивые): чем устойчивее структура, тем больше её вклад в гибрид. Отсюда следует:
3) Резонансный гибрид стабильнее чем любая из участвующих в резонансе структур. Такое увеличение устойчивости называют энергией резонанса
Описание слайда:
2.1. Все структуры, вклады которых существенны, должны располагать одинаковым (наименьшим) числом неспаренных электронов:
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
ВКЛАДЫ ГРАНИЧНЫХ СТРУКТУР В ГИБРИД
2.2. Локализация заряда: из двух структур с разде-лёнными зарядами более устойчивой будет та структура, у которой минус-заряд будет расположен на более ЭО атоме:
•
•
I
II
III- вклад
не существенен
С ─ О
−
+
С ─ О
+
−
более устойчива
Описание слайда:
2.3. Чем больше степень разделения зарядов в граничной структуре, тем меньше значение этой структуры для описания резонансного гибрида:
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
ВКЛАДЫ ГРАНИЧНЫХ СТРУКТУР В ГИБРИД
Н2C = CН2
Н2C CН2
+
−
··
2.4. Соблюдение правила октета (полнота или неполнота заполнения октета) :
Н2C = CН − Cl
··
··
··
Н2C CН = Cl
··
··
+
−
··
I
II
Несмотря на то, что в структуре II «» заряд расположен на более ЭО атоме, вклад этой структуры будет более существенным, так как соблюдается правило октета: в валентной оболочке атома Cl находится четыре пары электронов ( две неподелённые и две связывающие).
Описание слайда:
ДОМАШНЕЕ ЗАДАНИЕ
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
Нарисовать граничные (канонические) структуры, находя-щиеся в резонансе со структурами изображёнными ниже:
Описание слайда:
ДОМАШНЕЕ ЗАДАНИЕ
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
Нарисовать граничные (канонические) структуры, находя-щиеся в резонансе со структурами изображёнными ниже:
Описание слайда:
ДОМАШНЕЕ ЗАДАНИЕ
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА
Нарисовать граничные (канонические) структуры, находя-щиеся в резонансе со структурами изображёнными ниже:
Описание слайда:
Описание слайда:
Описание слайда:
2) Если участвующие в резонансе структуры близки по устойчивости (т.е. содержат примерно одинаковое количество энергии), то в этом случае резонанс будет весьма существенным. Вклад каждой структуры в гибрид зависит от относительной устойчивости структур: чем устойчивее структура, тем больше её вклад.
Отсюда следует:
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.