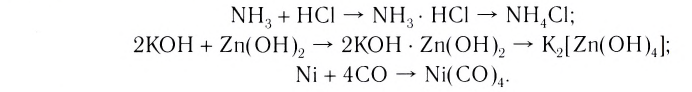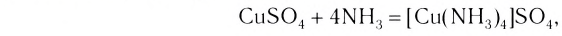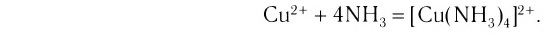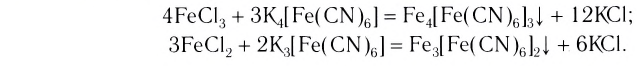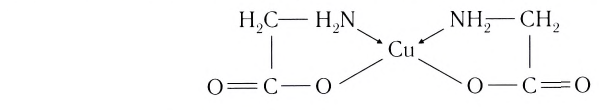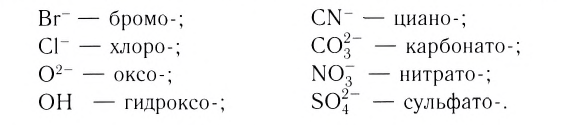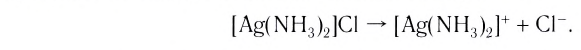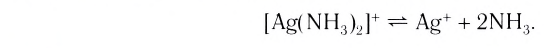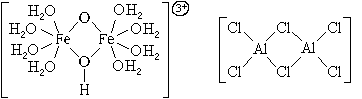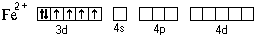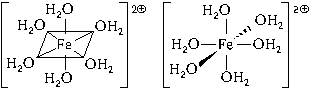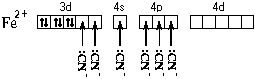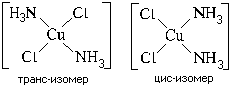Урок №15. Комплексные соединения
Na 2 [Zn(OH) 4 ] →2Na + + [Zn(OH) 4 ] 2-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Координационное число зависит:
от природы центрального атома;
условий образования комплексов.
Виды комплексов
Соединения с комплексными анионами
Соединения с комплексными катионами
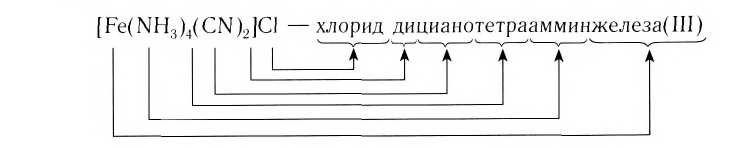
[Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
[Al(H 2 O) 5 OH]SO 4 – сульфат гидроксопентаакваалюминия
[Pt(H 2 O)(NH 3 ) 2 OH] NO 3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
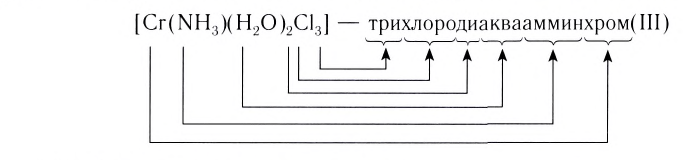
[Pt(NH 3 ) 2 Cl 2 ] – дихлородиамминплатина (II)
[Co(NH 3 ) 3 Cl 3 ] – трихлоротриамминкобальт (III)
Номенклатура
в названиях комплексных ионов сначала указываются лиганды;
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
в названиях комплексных катионов используются русские названия металлов;
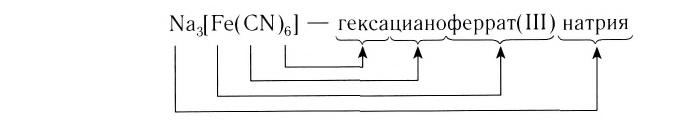
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
Составление координационных формул комплексных соединений
Решение задач на составление уравнений диссоциации комплексных соединений
Задание 301
Определите заряд комплексного нона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, К2[PtCl6], К[Аg(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах.
Решение:
Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисения всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О,NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
Заряд иона Координ. число Степень окисл.
Комплексные соединения диссоциируют как сильные электролиты необратимо:
Задание 302
Составьте координационные формулы следующих комплексных соединений платины:
РtCl4 . 6NH3; РtCl4 . 4NH3; РtCl4 . 2NH3. Координационное число платины (IV) равно шести. Напишите уравнение диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
Решение:
Формулы комплексных соединений:
Уравнения диссоциации этих комплексных соединений:
Уравнения диссоциации этих комплексных соединений:
Содержание:
Комплексные соединения:
Наиболее обширный и разнообразный класс неорганических веществ представляют комплексные соединения. В переводе с латинского complexus означает «сочетание». И действительно, большинство комплексных соединений образуется в результате соединения (сочетания) более простых веществ:
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a
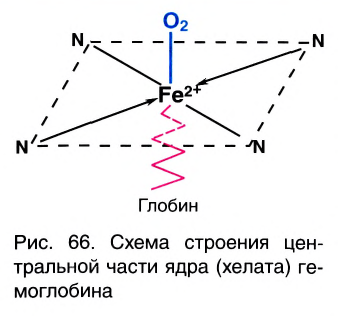
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) элекрезультате соединения (сочетания) более простых веществ:
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a NH3 ■ HCI — твердая соль, Ni — металл, СО — газ, а продукт их взаимодействия — бесцветная, легко испаряющаяся жидкость.
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных ионов и способные к самостоятельному существованию в растворах.
Альфред Вернер
(1866—1919)
Швейцарский химик-неорганик. Один из создателей координационной теории комплексных соединений. Лауреат Нобелевской премии (1913).
Основные представления о строении комплексных соединений
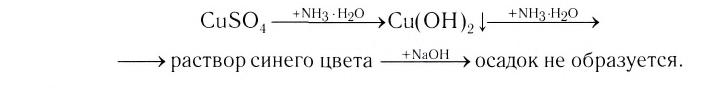
Проведем следующий эксперимент: каплю концентрированного раствора аммиака прильем к раствору сульфата меди(II) CuS04. Образуется голубой осадок гидроксида меди(II) Си(ОН)2, Продолжим добавлять раствор аммиака — осадок растворяется, а раствор приобретает ярко-синий цвет. Если затем добавить к полученному раствору раствор гидроксида натрия — осадок гидроксида меди(II) не образуется:
Значит, ионов Си 2+ в растворе практически нет. В то же время, ионы S04 легко обнаруживаются в растворе при добавлении BaCl2. Следовательно, при приливании избытка аммиака к осадку гидроксида меди(II) образовалось новое соединение.
Как показывает химический анализ, из раствора можно выделить кристаллы 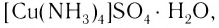

или в сокращенном ионном виде:
Рассмотрим структуру комплексных соединений. В составе комплексного иона выделяют центральный атом (или ион) — комплексообразователь. В нашем примере — это ион меди(II). В качестве комплексообразователей могут в принципе выступать любые атомы или ионы, но наиболее характерна способность к комплексообразованию для катионов переходных металлов (d-элементов).
Вокруг комплексообразователя группируются (координируются) другие атомы, ионы (чаще анионы) или нейтральные молекулы, которые называются лигандами. Например, лигандами могут выступать нейтральные молекулы: воды Н20, аммиака NH3, оксида углерода(II) СО, этилендиамина 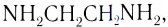
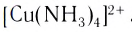
Слово «лиганд» образовано от латинского «ligo» — «связываю». Впервые этот термин в химическую литературу был введен немецким химиком А. Штоком в начале XX в. Однако в современном его значении слово «лиганд» ввел в научную литературу датский ученый Н. Бьеррум.
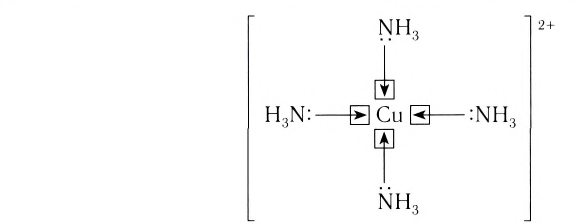
Число, показывающее, сколько лигандов (ионов или молекул) присоединено к данному комплексообразователю, называется его координационным числом. Так, в комплексном ионе 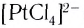
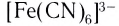
Лиганды могут образовывать химические связи с комплексообразователей посредством одного или нескольких атомов, входящих в их состав. В зависимости от количества таких атомов лиганды подразделяют на монодентатные и полидентатные (от лат. dentatus — «имеющий зубы»). Пример монодентатного лиганда — аммиак NH3, молекулы которого присоединяются к комплексообразователю посредством атома азота, имеющего одну неподеленную пару электронов:
Бидентатными лигандами являются карбонат-ионы 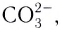
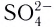
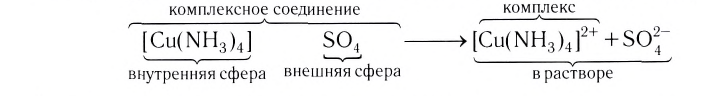
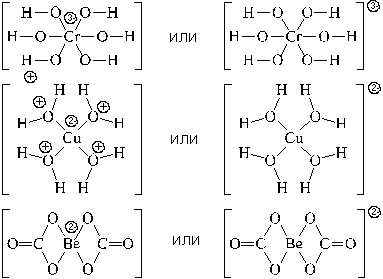
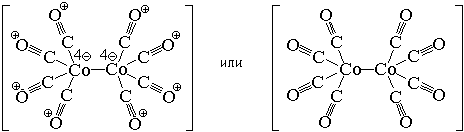
Центральный атом и лиганды образуют внутреннюю сферу — комплексный ион, или комплекс, который способен к самостоятельному существованию в растворе. При написании формул комплексных соединений внутреннюю сферу обычно заключают в квадратные скобки:
Такие формулы называются координационными.
Ионы, окружающие комплексный ион, составляют внешнюю сферу:
Поскольку комплексные соединения в целом электронейтральны, то частицы внешней сферы нейтрализуют заряд внутренней сферы. При диссоциации комплексного соединения в водных растворах образуются комплексные ионы и ионы внешней сферы. Комплексные соединения могут быть кислотами (например, 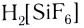
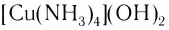
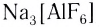
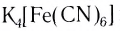
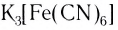
При взаимодействии хлорида железа (III) с раствором желтой кровяной соли 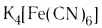
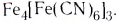
Классификация, номенклатура и устойчивость комплексных соединений
Комплексные соединения весьма разнообразны по составу, строению и свойствам. Существует несколько способов классификации комплексных соединений, основанных на различных принципах.
Классификация комплексных соединений
Наиболее распространенной является классификация по природе лигандов. В зависимости от природы лигандов различают:
Выделяют также циклические, или хелатные (клешневидные), комплексные соединения, содержащие би- и полидеитатные лиганды, связанные с центральным атомом связями, образованными по разным механизмам:
Лиганд, подобно клешням рака, как бы захватывает центральный атом.
На этих и последующих схемах ковалентные связи, образованные за счет неспаренных электронов, обозначены черточками, а образованные по донорно-акцепторному механизму — стрелками.
По знаку электрического заряда внутренней сферы различают комплексы:
Нейтральные комплексы не имеют внешней сферы и являются неэлектролитами.
Существуют также координационные соединения, состоящие из комплексных катионов и комплексных анионов, например 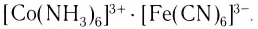
Номенклатура комплексных соединений
Знакомясь с новым классом химических соединений — комплексными соединениями, рассмотрим более подробно основные принципы их номенклатуры.
При написании формулы внутренней сферы комплексного соединения вначале записывают центральный атом (Me), а затем лиганды (L) с указанием их числа n. При этом лиганды, в зависимости от их заряда, располагаются в следующем порядке. Сначала записываются электронейтральные лиганды, а затем — лиганды с отрицательным зарядом:
Название комплексного соединения состоит из названия комплексного иона и названия противоиона. При этом сначала указывается анион в именительном падеже, а затем катион в родительном, независимо от того, какой из этих ионов комплексный (Согласно номенклатурным правилам ИЮПАК порядок названия комплексного соединения обратный. При этом и катион, и анион называют в именительном падеже).
Название комплексного иона строится по схеме 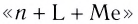
Нейтральные лиганды называют так же, как молекулы, например 
И, наконец, называют центральный атом или ион, указывая римской цифрой в круглых скобках степень окисления центрального атома. Если это комплексный катион, то название центрального атома не меняется:
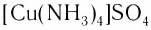
В названии комплексного аниона к корню латинского названия комплексообразователя добавляют суффикс -aт:
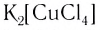
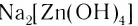
В названии нейтрального комплекса перечисляются все лиганды, а затем указывается русское название комплексообразователя в именительном падеже:
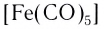
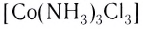
Устойчивость комплексных соединений
Большинство комплексных соединений при обычных условиях представляют собой твердые вещества, как правило, хорошо растворимые в воде. Ионная связь между внешней и внутренней сферами комплексного соединения при растворении вещества в воде легко разрушается. Происходит первичная диссоциация, которая протекает по типу диссоциации сильных электролитов:
Диссоциация внутренней сферы комплекса, называемая вторичной, протекает по типу диссоциации слабых электролитов и характеризуется наличием равновесия между комплексом, центральным ионом и лигандами:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Как написать формулу комплексного соединения
17.1. Основные определения
В этой главе вы познакомитесь с особой группой сложных веществ, называемых комплексными (или координационными) соединениями.
| Комплексное соединение – химическое вещество, в состав которого входят комплексные частицы. |
В настоящее время строгого определения понятия » комплексная частица» нет. Обычно используется следующее определение.
| Комплексная частица – сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. |
Например, гидратированный ион меди [Cu(H2O)4] 2 





Примеры других комплексных частиц: [Zn(OH)4] 2 


Вместе с тем к комплексным частицам относят ионы NH4 


Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. В большинстве комплексных частиц так и есть, но, например, в алюмокалиевых квасцах [K(H2O)6][Al(H2O)6]SO4 в комплексной частице [Al(H2O)6] 3 



По заряду комплексные частицы могут быть катионами, анионами, а также нейтральными молекулами. Комплексные соединения, включающие такие частицы, могут относиться к различным классам химических веществ (кислотам, основаниям, солям). Примеры: (H3O)[AuCl4] – кислота, [Ag(NH3)2]OH – основание, NH4Cl и K3[Fe(CN)6] – соли.
Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; при образовании комплексного соединения из более простых веществ она не меняется.
| Лиганды – атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. |
Если лиганды унидентатные, то координационное число равно числу таких лигандов.
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Существуют комплексные частицы и с несколькими центральными атомами.
| Внутренняя сфера комплексного соединения – центральный атом со связанными с ним лигандами, то есть, собственно комплексная частица. Внешняя сфера комплексного соединения – остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные. |
Используются два вида структурных формул комплексных частиц: с указанием формального заряда центрального атома и лигандов, или с указанием формального заряда всей комплексной частицы. Примеры:
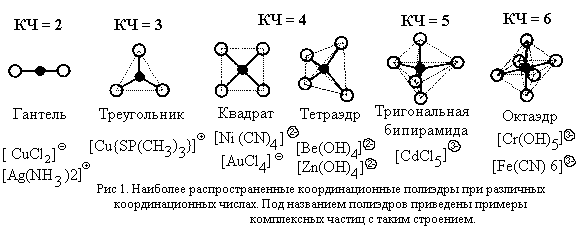
Для характеристики формы комплексной частицы используется представление о координационном полиэдре (многограннике).
| Координационный полиэдр – воображаемый многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах – атомы лигандов, непосредственно связанные с комплексообразователем. |
К координационным полиэдрам относят также квадрат (КЧ = 4), треугольник (КЧ = 3) и гантель (КЧ = 2), хотя эти фигуры и не являются многогранниками. Примеры координационных полиэдров и имеющих соответствующую форму комплексных частиц для наиболее распространенных значений КЧ приведены на рис. 1.
Как химические вещества комплексные соединения делятся на ионные (их иногда называют ионогенными) и молекулярные (неионогенные) соединения. Ионные комплексные соединения содержат заряженные комплексные частицы – ионы – и являются кислотами, основаниями или солями (см. § 1). Молекулярные комплексные соединения состоят из незаряженных комплексных частиц (молекул), например: [Fe(CO)5] или [Cr(C6H6)2] – отнесение их к какому-либо основному классу химических веществ затруднительно.
Входящие в состав комплексных соединений комплексные частицы довольно разнообразны. Поэтому для их классификации используется несколько классификационных признаков: число центральных атомов, тип лиганда, координационное число и другие.
По числу центральных атомов комплексные частицы делятся на одноядерные и многоядерные. Центральные атомы многоядерных комплексных частиц могут быть связаны между собой либо непосредственно, либо через лиганды. И в том, и в другом случае центральные атомы с лигандами образуют единую внутреннюю сферу комплексного соединения:
По типу лигандов комплексные частицы делятся на
1) Аквакомплексы, то есть комплексные частицы, в которых в качестве лигандов присутствуют молекулы воды. Более или менее устойчивы катионные аквакомплексы [M(H2O)n] m 
2) Гидроксокомплексы, то есть комплексные частицы, в которых в качестве лигандов присутствуют гидроксильные группы, которые до вхождения в состав комплексной частицы были гидроксид-ионами, например: [Zn(OH)4] 2 


Гидроксокомплексы образуются из аквакомплексов, проявляющих свойства катионных кислот:
[Zn(H2O)4] 2 


3) Аммиакаты, то есть комплексные частицы, в которых в качестве лигандов присутствуют группы NH3 (до образования комплексной частицы – молекулы аммиака), например: [Cu(NH3)4] 2 


Аммиакаты также могут быть получены из аквакомплексов, например:
[Cu(H2O)4] 2 

Окраска раствора в этом случае меняется с голубой до ультрамариновой.
4) Ацидокомплексы, то есть комплексные частицы, в которых в качестве лигандов присутствуют кислотные остатки как бескислородных, так и кислородсодержащих кислот (до образования комплексной частицы – анионы, например: Cl 








Примеры образования ацидокомплексов:
Hg 2 


AgBr + 2S2O3 2 

Последняя реакция используется в фотографии для удаления с фотоматериалов непрореагировавшего бромида серебра.
(При проявлении фотопленки и фотобумаги незасвеченная часть бромида серебра, содержащегося в фотографической эмульсии, не восстанавливается проявителем. Для ее удаления и используют эту реакцию ( процесс носит название «фиксирования», так как неудаленный бромид серебра в дальнейшем на свету постепенно разлагается, разрушая изображение)
5) Комплексы, в которых лигандами являются атомы водорода, делятся на две совершенно разные группы: гидридные комплексы и комплексы, входящие в состав ониевых соединений.
При образовании гидридных комплексов – [BH4] 


В ониевых комплексах центральный атом является донором электронов, а акцептором – атом водорода в степени окисления +1. Примеры: H3O 






6) Карбонильные комплексы – комплексы, в которых в качестве лигандов присутствуют группы CO (до образования комплекса – молекулы монооксида углерода), например: [Cr(CO)6], [Fe(CO)5], [Ni(CO)4] и др.
7) Анионгалогенатные комплексы – комплексы типа [I(I)2] 
По типу лигандов выделяют и другие классы комплексных частиц. Кроме того существуют комплексные частицы с различными по типу лигандами; простейший пример – аква-гидроксокомплекс [Zn(H2O)3(OH)] 
Формула комплексного соединения составляется также, как и формула любого ионного вещества: на первом месте записывается формула катиона, на втором – аниона.
Формула комплексной частицы записывается в квадратных скобках в следующей последовательности: на первом месте ставится символ элемента-комплексообразователя, далее – формулы лигандов, бывших до образования комплекса катионами, затем – формулы лигандов, бывших до образования комплекса нейтральными молекулами, и после них – формулы лигандов, бывших до образования комплекса анионами.
Название комплексного соединения строится также, как и название любой соли или основания (комплексные кислоты называются солями водорода или оксония). В название соединения входит название катиона и название аниона.
В название комплексной частицы входит название комплексообразователя и названия лигандов (название записывается в соответствии с формулой, но справа налево. Для комплексообразователей в катионах используются русские названия элементов, а в анионах – латинские.
Названия наиболее распространенных лигандов:
| H2O – аква | Cl  – хлоро – хлоро | SO4 2  – сульфато – сульфато | OH  – гидроксо – гидроксо |
| CO – карбонил | Br  – бромо – бромо | CO3 2  – карбонато – карбонато | H  – гидридо – гидридо |
| NH3 – аммин | NO2  – нитро – нитро | CN  – циано – циано | NO  – нитрозо – нитрозо |
| NO – нитрозил | O 2  – оксо – оксо | NCS  – тиоцианато – тиоцианато | H +I – гидро |
Примеры названий комплексных катионов:
[Zn(H2O)4] 2  – ион тетрааквацинка – ион тетрааквацинка | [Fe(H2O)5Cl] 2  – ион хлоропентаакважелеза(III) – ион хлоропентаакважелеза(III) |
[Ag(NH3)2]  – ион диамминсеребра(I) – ион диамминсеребра(I) | [Al(H2O)4(OH)2]  – ион дигидроксотетраакваалюминия – ион дигидроксотетраакваалюминия |
[Cr(H2O)6] 3  – ион гексааквахрома(III) – ион гексааквахрома(III) | [Co(NH3)5SO3]  – ион сульфитопентаамминкобальта(III) – ион сульфитопентаамминкобальта(III) |
Примеры названий комплексных анионов:
[Zn(OH)4] 2 
[Ag(S2O3)2] 3 
[Cr(CN)6] 3 
[Al(H2O)2(OH)4] 
[Co(NH3)2(NO2)4] 
[Fe(H2O)(CN)5] 3 
Примеры названий нейтральных комплексных частиц:
| [Fe(CO)5] – пентакарбонилжелезо | [Cr(C6H6)2] – дибензолхром |
| [Co(NH3)Cl3] – трихлороамминкобальт | [Pt(NH3)2Br2] – дибромодиамминплатина |
Более подробные номенклатурные правила приводятся в справочниках и специальных пособиях.
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная.
В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму (как следствие – с изменением формальных зарядов). В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью.
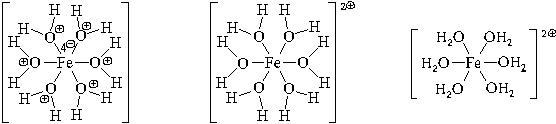
Рассмотрим ее образование на примере аквакатиона железа(II). Этот ион образуется по реакции:
FeCl2кр + 6H2O = [Fe(H2O)6] 2 
При образовании двухзарядного иона атом железа теряет два 4s-электрона:
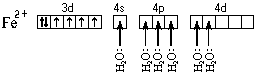
Ион железа акцептирует шесть электронных пар атомов кислорода шести молекул воды на свободные валентные орбитали:
Образуется комплексный катион, химическое строение которого можно выразить одной из следующих формул:
Пространственное строение этой частицы выражается одной из пространственных формул:
Если FeCl2 растворять в растворе, содержащем цианид-ионы, то протекает реакция
FeCl2кр + 6CN 


Тот же комплекс получается и при добавлении к раствору FeCl2 раствора цианида калия KCN:
Это говорит о том, что цианидный комплекс прочнее аквакомплекса. Кроме того магнитные свойства цианидного комплекса указывают на отсутствие неспаренных электронов у атома железа. Все это связано с несколько иным электронным строением этого комплекса:
» Сила» лиганда зависит прежде всего от электронной плотности облака неподеленной пары электронов, то есть, она увеличивается с уменьшением размера атома, с уменьшением главного квантового числа, зависит от типа гибридизации ЭО и от некоторых других факторов. Важнейшие лиганды можно выстроить в ряд по возрастанию их » силы» (своеобразный » ряд активности» лигандов), этот ряд называется спектрохимическим рядом лигандов:
I  ; Br ; Br  ; :SCN ; :SCN  , Cl , Cl  , F , F  , OH , OH  , H2O; :NCS , H2O; :NCS  , NH3; SO3S: 2 , NH3; SO3S: 2  ; :CN ; :CN  , CO , CO |
Для комплексов [Fe(H2O)6] 3 

Для комплексных соединений прежде всего характерны те же свойства, что и для обычных соединений тех же классов (соли, кислоты, основания).
Если комплексное соединение кислота, то это сильная кислота, если основание, то и основание сильное. Эти свойства комплексных соединений определяются только наличием ионов H3O 

[Cu(NH3)4]SO4 + BaCl2 = BaSO4 
FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]3 
Последняя из этих реакций используется в качестве качественной реакции на ионы Fe 3 
Кроме этого в реакцию может вступать и сама комплексная частица, причем, тем активнее, чем она менее устойчива. Обычно это реакции замещения лигандов, протекающие в растворе, например:
[Cu(H2O)4] 2 

а также кислотно-основные реакции типа
[Zn(OH)4] 2 

[Zn(H2O)4] 2 

Образующийся в этих реакциях [Zn(H2O)2(OH)2] после выделения и высушивания превращается в гидроксид цинка:
Последняя реакция – простейший пример разложения комплексного соединения. В данном случае она протекает при комнатной температуре. Другие комплексные соединения разлагаются при нагревании, например:
Для оценки возможности протекания реакции замещения лигандов можно использовать спектрохимический ряд, руководствуясь тем, что более сильные лиганды вытесняют из внутренней сферы менее сильные.
Изомерия комплексных соединений связана
1) с возможным различным расположением лигандов и внешнесферных частиц,
2) с различным строением самой комплексной частицы.
К первой группе относится гидратная (в общем случае сольватная) и ионизационная изомерия, ко второй – пространственная и оптическая.
Гидратная изомерия связана с возможностью различного распределения молекул воды во внешней и внутренней сферах комплексного соединения, например: [Cu(H2O)2Br2] (цвет красно-коричневый) и [Cu(H2O)4]Br2 (цвет голубой).
Ионизационная изомерия связана с возможностью различного распределения ионов во внешней и внутренней сфере, например: [Co(NH3)5Br]SO4 (пурпурного цвета) и [Co(NH3)5SO4]Br (красного цвета). Первое из этих соединений образует осадок, реагируя с раствором хлорида бария, а второе – с раствором нитрата серебра.
Пространственная (геометрическая) изомерия, иначе называемая цис-транс изомерией, характерна для квадратных и октаэдрических комплексов (для тетраэдрических невозможна). Пример: цис-транс изомерия квадратного комплекса [Pt(NH3)2Cl2]
Оптическая (зеркальная) изомерия по своей сути не отличается от оптической изомерии в органической химии и характерна для тетраэдрических и октаэдрических комплексов (для квадратных невозможна).

а) [Pb(OH)3] 




















Опыт 2. разрушение аквакомплекса. 1 микрошпатель гептагидрата сульфата никеля поместить в пробирку. Пробирку закрепить в штативе и сначала осторожно, а затем интенсивно нагреть на открытом пламени. Отметить изменения цвета соли. Зная, что на первом этапе удаляется одна молекула воды, а на втором шесть, составить, структурную формулу исходного соединения.
Опыт 4. Разрушение аммиаката. К раствору, содержащему аммиакат меди, полученный в предыдущем опыте, добавить несколько капель разбавленной серной кислоты до изменения окраски раствора. Составит уравнения реакций и объяснить происходящие изменения.
Опыт 7. Получение полигалогенида. 2-3 кристаллика йода поместить в пробирку и добавить в нее 2 капли воды. Что происходит? Добавить в пробирку 5-6 капель раствора йодида калия и перемешать. Наблюдать происходящие изменения. оставить уравнение реакции.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору