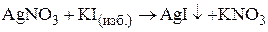Составление формулы мицеллы коллоидного раствора
Методические рекомендации
По решению задач
«Коллоидные растворы»
для специальностей 19.02.03 «Технология хлеба, кондитерских и макаронных изделий»; 19.02.05 «Технология бродильных производств и виноделие»; 19.02.10 «Технология продукции общественного питания»
Коллоидные растворы
Составление формулы мицеллы коллоидного раствора
Теоретические положения
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3.Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4.Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке, хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
AgNO3 + NaCl → NaNO3 + AgCl↓
Основу коллоидных частиц золя AgCl составляют микрокристаллы малорастворимого хлорида серебра, которые называются агрегатами, обозначаются m (AgCl).
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые достраивают кристаллическую решетку агрегата или содержатся в составе агрегата.

Гранула имеет вид:
Так как концентрация противоионов около поверхности больше, чем в растворе, то остальная часть противоионов Na + слабее связана с ядром и под влиянием теплового движения диффундирует в сторону с меньшей концентрацией, образуя диффузионный слой проивоионов.
Гранула вместе с диффузионным слоем образует мицеллу. Мицеллы золей электронейтральны.
Формула мицеллы:



m ‑ количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n – х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузионный слой.
Алгоритм составления формулы мицеллы
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1. Агрегатом является получающийся в ходе реакции осадок.
2. Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3. Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4. Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке, хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые достраивают кристаллическую решетку агрегата или содержатся в составе агрегата.
Так как концентрация противоионов около поверхности больше, чем в растворе, то остальная часть противоионов Na + слабее связана с ядром и под влиянием теплового движения диффундирует в сторону с меньшей концентрацией, образуя диффузионный слой проивоионов.
Гранула вместе с диффузионным слоем образует мицеллу. Мицеллы золей электронейтральны.
агрегат адсорбционный слой диффузионный слой
m #8209; количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n –х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузионный слой.
Задачи для самостоятельного решения:
1. Составить схему строения мицеллы золя гидроксида меди (II) в растворе хлорида меди.
2.Составить формулу мицеллы по уравнению: FeCL3 +3NaOH=Fe(OH)3+3NaCl
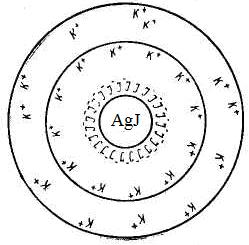
3. Золь иодида серебра получен при добавлении к раствору AgNO3 избытка KI. Определить заряд частиц полученного золя и написать формулу его мицеллы.
4. Напишите формулу мицеллы сульфата бария, полученного сливанием одинакового объема сильно разбавленной серной кислоты и менее разбавленного раствора хлорида бария.
5. Золь сернокислого бария получен смешением равных объемов растворов Ва(NО3)2 иН2SО4. Написать формулу мицеллы.
6. Золь Аl(ОН)3 получен смешением равных объемов растворов АlCl3 и NaОН. Напсать формулу мицеллы золя.
Самостоятельная работа № 8
Тема 2.3. Растворы высокомолекуляр-ных соединений
Задания
1. Выполнение домашних заданий по теме 2.3
2. Составление конспекта по учебнику о высокомолекулярных соединениях. Их роль в природе, технологии пищевых и рыбных продуктов.
Порядок выполнения задания: составление конспекта о высокомолекулярных соединениях. Их роль в природе, технологии пищевых и рыбных продуктов.
Методические рекомендации по написанию конспекта представлены в самостоятельной работе № 4.
Список литературы
1. Белик В.В. Физическая и коллоидная химия: учебник для студ. учреждений сред. проф. образования – М.: «Академия», 2013. – 288 с.

Формула мицеллы
Записывая взаимное расположение составляющих мицеллы, начиная от её центра по направлению к периферии, мы получим формулу мицеллы.В данном примере она носит название «формула мицеллы золя сульфата бария, полученного в избытке хлорида бария» (или «стабилизированного хлоридом бария»):
агрегат ПОИ противоионы противоионы
В формуле мицеллы в квадратные скобки принято заключать химическую формулу агрегата. Коэффициент m показывает, что в агрегат входит какое-то достаточно большое число (сотни или тысячи) молекул вещества. Точно определить это число сложно и для практических целей оно несущественно. Достаточно знать, что m намного больше единицы.
Встречается и другое написание формулы агрегата: m [BaSO4]. Но нам представляется, что в этом случае коэффициент m скорее указывает на множественность агрегатов, чего не может быть в одной мицелле, а не на сложность строения самого агрегата.
В фигурные скобки заключается гранула. Иными словами, фигурные скобки соответствуют поверхности скольжения.
Перед формулой потенциалопределяющего иона ставится коэффициент n. Его буквенное обозначение также говорит о неопределённо большом числе этих ионов. Следует помнить, что m ¹ n, причём, как правило, m >> n.
Так как потенциалопределяющие ионы, ядро и гранула рассматриваемого коллоидного раствора заряжены положительно, его можно назвать «положительным золем сульфата бария».
агрегат ПОИ противоионы противоионы
По заряду потенциалопределяющих ионов, ядра и гранулы этот золь называется отрицательным золем сульфата бария.
В некоторых случаях, отвечающих сжатию ДЭС мицеллы до «гельмгольцевского» слоя, мицелла переходит в изоэлектрическое состояние. Оно соответствует сжатию мицеллы до размеров гранулы, что может быть выражено следующей формулой:
В изоэлектрическом состоянии, когда их z-потенциал равен нудю, золи обладают наименьшей агрегативной устойчивостью.
На приведённых примерах можно убедиться, что ДЭС мицеллы бывает образован ионами того электролита, который при получении золя присутствовал в реакционной смеси в некотором избытке. Этот электролит называется стабилизатором, т. к. из дальнейшего изложения будет видно, что именно ДЭС является главным фактором, обусловливающим агрегативную устойчивость коллоидных растворов. Поэтому можно предложить ещё одно название рассмотренных золей: «коллоидный раствор (золь) сульфата бария, стабилизированный хлоридом бария» и, соответственно, «коллоидный раствор (золь) сульфата бария, стабилизированный серной кислотой». Из этого также должно стать понятным, что пептизатор, вызывающий переход рыхлого осадка в коллоидный раствор, по сути дела является стабилизатором, восстанавливающим двойной электрический слой частиц, разрушенный при образовании осадка.
Во многих случаях ДЭС на поверхности мицелл может возникать из ионов, образующихся при поверхностных реакциях вещества твёрдой фазы с веществами, присутствующими в дисперсионной среде, как, например, при получении золей методами физической конденсации или диссолюционной пептизации.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Строение коллоидных мицелл



Коллоидные системы состоят из дисперсной фазы и дисперсионной среды. Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой.
Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Как правило, агрегат состоит из большого числа молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора – потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса – Панета – Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
— входят в состав агрегата;
— способны достраивать кристаллическую решетку агрегата;
— образуют малорастворимое соединение с ионами агрегата;
— изоморфны с ионами агрегата».
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу (гранулу) окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Пример 4.2. Рассмотрим строение мицеллы при образовании коллоидного раствора – золя иодида серебра методом химической конденсации при небольшом избытке нитрата серебра
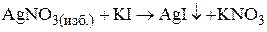
Рис. 4.11. Схематическое строение мицеллы золя иодида серебра
Формула мицеллы запишется:
где m – количество молекул или атомов, образующих агрегат; n – число потенциалопределяющих ионов, адсорбированных на поверхности агрегата; (n – x) – число противоионов в плотной части двойного электрического слоя (адсорбционный слой); x – число противоионов в диффузной части двойного электрического слоя; 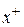
При образовании золя иодида серебра при небольшом избытке иодида калия
образуется мицелла следующего состава:
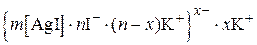
Заряд коллоидной частицы в этом случае будет отрицательным.
Образование ДЭС в присутствии электролита-стабилизатора обеспечивает электростатический фактор устойчивости дисперсной системе, который усиливается с ростом потенциала поверхности и толщины ДЭС. Он очень чувствителен к действию электролитов и характерен для систем с полярными, особенно водными средами, создающими условия для диссоциации. Наряду с электростатическим, в дисперсных схемах возможно проявление и других факторов стабилизации.
Задачи к разделу Дисперсные системы. Коллоидные растворы
Здесь Вы найдете задач по теме Дисперсные системы и Коллоидные растворы. Это задачи на строение коллоидных частиц (составление формулы мицеллы золя) и коагуляция золей.
Задача 1. Какой объем 0,001 н. раствора BaCl2 надо добавить к 0,03 л 0,001 н. раствора K2CrO4, чтобы получить положительно заряженные частицы золя BaCrO4? Составьте формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат калия или фосфат калия. Поясните выбор.
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
BaCl2 + K2CrO4 = BaCrO4↓ + 2KCl
Найдем необходимый объем BaCl2 при условии, что вещества участвуют в реакции в стехиометрическом соотношении, используя «золотое правило аналитики»:
Подставим в выражение известные значения:
0,001·0,03 = 0,001·VBaCl2, откуда
На поверхности образовавшегося золя адсорбируются ионы, входящие в его состав и находящиеся в растворе в избытке.
Формула мицеллы золя будет выглядеть следующим образом:
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат калия или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
Допустим, что коагуляцию золя вызывают катионы, тогда все приведенные соединения обладают одинаковым коагулирующим действием.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать фосфат калия K3PO4, т.к. фосфат-ион имеет наибольший заряд.
Задача 2. Золь Al(OH)3 получен при добавлении к 0,005 л 0,001 н. раствора AlCl3 0,002 л 0,0015 н. раствора NaOH. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат калия, сульфат магния или фосфат калия. Поясните выбор.
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
Определим количества участвующих в реакции веществ:
Формула мицеллы золя будет выглядеть следующим образом:
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат калия, сульфат магния или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
Допустим, что коагуляцию золя вызывают катионы, тогда наиболее сильным коагулирующим действием будет обладать сульфат магия MgSO4, т.к заряд иона магния имеет наибольшее значение.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать фосфат калия K3PO4, т.к. фосфат-ион имеет наибольший заряд.
Задача 3. Какой объем 0,0025 н. раствора KI надо добавить к 0,035 л 0,003 н. раствора Pb(NO3)2, чтобы получить золь PbI2, противоионы которого двигались бы в электрическом поле к аноду? Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид натрия, сульфат натрия или фосфат калия. Поясните выбор.
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
2KI + Pb(NO3)2 = PbI2↓+ 2KNO3
При образовании золя PbI2, на его поверхности адсорбируются потенциалопределяющие ионы, входящие в его состав и находящиеся в растворе в избытке.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата.
Таким образом, в растворе должен быть избыток Pb(NO3)2.
Применяя «золотое правило аналитики», найдем объем KI:
Подставим в выражение известные значения:
0,0025·VKI = 0,003·0,035, откуда
Следовательно, чтобы достичь избытка Pb(NO3)2, объем VKI должен быть менее 0,042 л.
Формула мицеллы золя будет выглядеть следующим образом:
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид натрия, сульфат натрия или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
Допустим, что коагуляцию золя вызывают катионы, тогда все приведенные соединения обладают одинаковым коагулирующим действием, т.к. все катионы имеют положительный заряд.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать фосфат калия K3PO4, т.к. фосфат-ион имеет наибольший заряд.
Задача 4. Золь Mg3(РО4)2 получен при добавлении к 0,015 л 0,002 н. раствора Na3PO4 0,005 л 0,004 н. раствора MgCl2. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат меди или нитрат алюминия. Поясните выбор.
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
Определим количества участвующих в реакции веществ:
n(MgCl2)= Сн·V = 0,004·0,005 = 0,00002 моль
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата – Na +
Формула мицеллы золя будет выглядеть следующим образом:
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат меди или нитрат алюминия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
Допустим, что коагуляцию золя вызывают катионы, тогда наибольшим коагулирующим действием обладает нитрат алюминия Al(NO3)3, т.к. ион Al 3+ имеет наибольший заряд.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать сульфат меди CuSO4, т.к. сульфат-ион имеет наибольший заряд.
Задача 5. Золь Zn(OH)2 получен при взаимодействии растворов КОН и ZnCl2. Составьте формулу мицеллы золя, если противоионы движутся в электрическом поле к катоду. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат калия, сульфат никеля или сульфат хрома. Поясните выбор.
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
2KOH + ZnCl2 = Zn(OH)2↓+ 2KCl
При образовании золя Zn(OH)2, на его поверхности адсорбируются потенциалопределяющие ионы, входящие в его состав и находящиеся в растворе в избытке.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата.
По условию задачи, противоионы движутся к катоду, значит, они заряжены положительно, а потенциалопределяющие ионы будут заряжены отрицательно.
В нашем примере, в качестве потенциалопределяющих ионов будут выступать гидроксид-ионы. В результате, (Zn(OH)2)m с адсорбированным слоем OH — приобретает отрицательный заряд.
Формула мицеллы золя будет выглядеть следующим образом:
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат калия, сульфат никеля или сульфат хрома. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
Допустим, что коагуляцию золя вызывают анионы, тогда наибольшим коагулирующим действием обладают сульфат никеля NiSO4 и сульфат хрома Cr2(SO4)3.
Если же коагуляция золя вызвана катионами, то более сильным коагулирующим действием будет обладать сульфат хрома Cr2(SO4)3, т.к. ион хрома имеет наибольший заряд.
Задача 6. Золь Ag2S получен при добавлении к 0,015 л 0,003 н. раствора Na2S 0,035л 0,0005 н. раствора AgNO3. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат цинка или фосфат калия. Поясните выбор.
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
Определим количества участвующих в реакции веществ:
n(Na2S)= Сн·V = 0,003·0,015 = 0,000045 моль
n(AgNO3)= Сн·V = 0,0005·0,035 = 0,0000175 моль
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой.
Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата – Na +
Формула мицеллы золя будет выглядеть следующим образом:
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат цинка или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
Допустим, что коагуляцию золя вызывают анионы, тогда наибольшим коагулирующим действием обладают фосфат калия K3PO4, т.к. фосфат-ион PO4 3- имеет наибольший заряд.
Если же коагуляция золя вызвана катионами, то более сильным коагулирующим действием будет обладать сульфат цинка ZnSO4, т.к. ион цинка Zn 2+ имеет наибольший заряд.
Задача 7. Золь Fe(OH)3 получен смешиванием равных объемов 0,0001 н. раствора KOH и 0,00015 н. раствора FeCl3. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат свинца, сульфат марганца или фосфат калия. Поясните выбор.
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
3KOH + FeCl3 = Fe(OH)3↓+ 3KCl
По условию задачи объемы смешиваемых растворов равны, поэтому в избытке будет находиться вещество с наибольшей концентрацией, т.е. хлорид железа FeCl3.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой.
Формула мицеллы золя будет выглядеть следующим образом:
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат свинца, сульфат марганца или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. По правилу Шульца-Гарди коагулирующая способность иона тем больше, чем больше его заряд.
Допустим, что коагуляцию золя вызывают анионы, тогда наибольшим коагулирующим действием обладают фосфат калия K3PO4, т.к. фосфат-ион PO4 3- имеет наибольший заряд.
Если же коагуляция золя вызвана катионами, то более сильным коагулирующим действием будут обладать нитрат свинца Pb(NO3)2и сульфат марганца МnSO4, т.к. ионы свинца Pb 2+ и марганца Мn 2+ имеют наибольший заряд, по сравнению с ионом K +