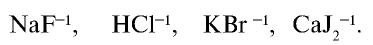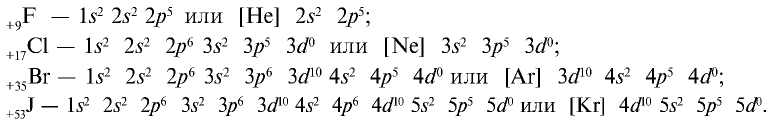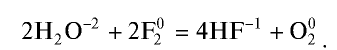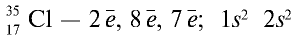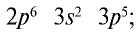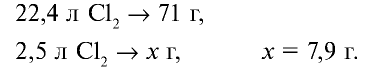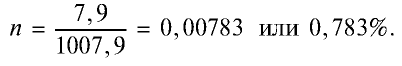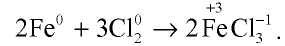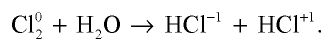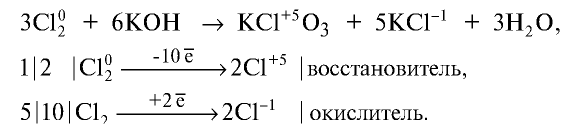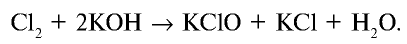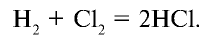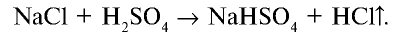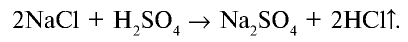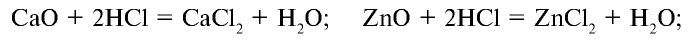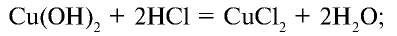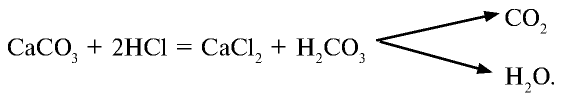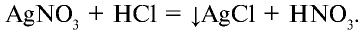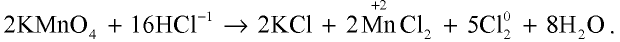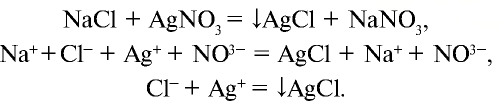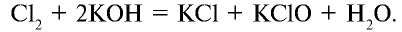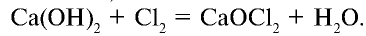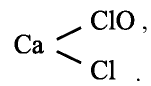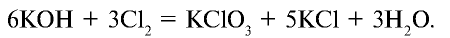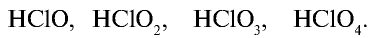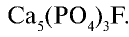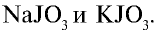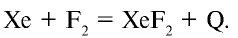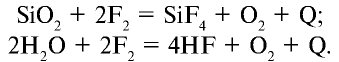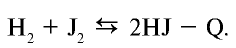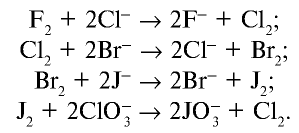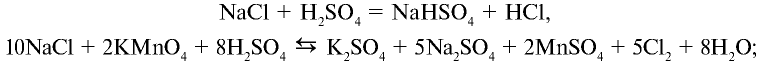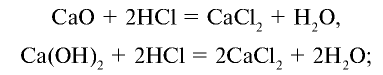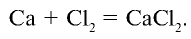Галогены в химии: что это, их характеристики и свойства, примеры
Содержание:
Галогены – элементы, находящиеся в VIIA группе. Они взаимодействуют со многими неорганическими и органическими соединениями. К ним относятся:
Галогены широко распространены в природных условиях.
Строение галогенов
На наружном уровне галогенов располагается шесть спаренных и один неспаренный электрон. До устойчивого состояния элементам недостает одного электрона, поэтому они относятся к сильным окислителям. Молекулы галогенов состоят из двух атомов.
У галогенов в соединениях, как правило, отрицательная степень окисления:
В некоторых соединениях для них характерна положительная степень окисления:
Фтор – самый электроотрицательный элемент, который окисляет даже кислород. Таким образом, существует фторид кислорода OF2.
Закономерности галогенов
В ряду F-Cl-Br-I уменьшается электроотрицательность. Следовательно, фтор – самый активный элемент. У него самый маленький атомный радиус, поэтому он активно притягивает к себе электроны.
Физические свойства
В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.
Способы получения
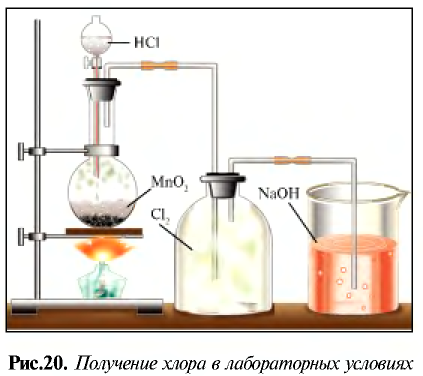
Получение хлора
В промышленности хлор получают путем электролиза.
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
Получение фтора
Фтор получают с помощью электролиза расплава.
Получение брома
Бром получают с помощью окисления.
Получение йода
Йод получают с помощью окисления.
Химические свойства
Галогены – окислители, которые реагируют с металлами и неметаллами.
В реакциях со сложными веществами галогены ведут себя как окислители.
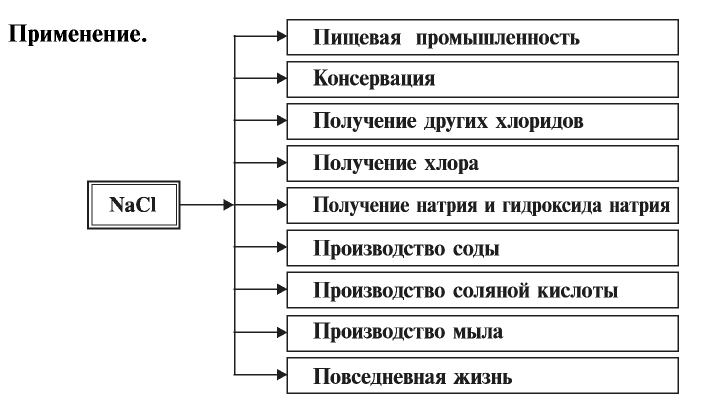
Применение галогенов
Костная ткань и зубная эмаль включают соединения фтора. При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фторид кислорода используется в производстве ракетного топлива. Соединения фтора входят в состав зубных паст. С помощью молекулярного хлора обеззараживают воду, а также используют для отбеливания тканей, бумаги, древесины. Поваренная соль – хлорид натрия, который добавляется в пищу. А хлорид калия применяется в качестве удобрения.
Галогены
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Природные соединения
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание:
Понятие «галоген» было введено в науку в 1811 г. немецким химиком И. Швейгером и означало «образующий соль».
Галогенами называют фтор, хлор, бром, йод и астат. Все галогены являются неметаллами и в периодической таблице химических элементов занимают основную подгруппу седьмой группы.
На внешнем энергетическом уровне атомы галогенов имеют семь электронов и для заполнения этого уровня восемью электронами им недостает одного электрона. Поэтому они присоединяют по одному электрону от атомов водорода и металлов и проявляют степень окисления, равную —1:
Строение атомов галогенов
Распространение в природе
Так как галогены являются сильными окислителями, в свободном состоянии в природе они не встречаются и находятся в основном в виде химических соединений (табл. 23).
Таблица 23
Распространение галогенов в природе
| Химический элемент | Количество в земной коре, % | Природные соединения |
| Фтор | 0,027 | Плавиковый шпат 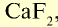 , апатит, фосфориты , апатит, фосфориты |
| Хлор | 0,045 | Хлориды: КС1, NaCl |
| Бром | 0,00016 | Бромиды: NaBr, KBr, MgBr, 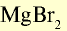 |
| 0,00003 | Йодиды: NaJ, KJ |
Получение галогенов
В связи с тем, что в природных соединениях галогены имеют в основном отрицательную (—1) степень окисления, выделение их в свободном состоянии проводится путем окисления ионов галогенидов.
Физические свойства галогенов
О некоторых свойствах галогенов вы узнали при изучении природных семейств химических элементов. С возрастанием относительных атомных масс галогенов их физические свойства изменяются по определенной закономерности.
Агрегатные в обычных условиях состояния и цвет постепенно сгущаются.
Фтор — газ светло-зеленого цвета, хлор — тяжелый газ желто-зеленого цвета, бром — жидкость красновато-бурого цвета, йод — кристаллическое вещество темно-серого цвета. Температура кипения и плотность постепенно увеличиваются от фтора к йоду.
Водорастворимость галогенов относительно невелика. Так, в одном объеме воды в обычных условиях растворяется 2,5 объема хлора, водорастворимость йода составляет 0,02 на 100 г воды. Галогены хорошо растворяются в органических растворителях (керосин, бензин, ацетон, различные спирты, бензол и др.).
Йод обладает сублимирующим свойством, то есть при накаливании он превращается в газ фиолетового цвета.
— Явление перехода веществ из твердого состояния в газообразное, а из газообразного в твердое, минуя жидкое, называется сублимацией.
Химические свойства галогенов
Радиусы атомов галогенов увеличиваются от фтора к йоду (в ряду 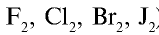
В ряду 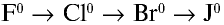
В ряду 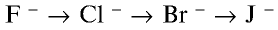
Фтор — самый активный среди галогенов. Под влиянием фтора окисляется даже кислород. При взаимодействии с водой он горит ярким пламенем:
Элементы знаний, умений и навыков: галогены, сублимация.
Хлор — ядовитый газ, натрий — щелочной металл.
Галогены и их соединения имеют большое значение в народном хозяйстве. Хлор и его соединения занимают важное место в ряду галогенов. Поэтому рассмотрим свойства хлора подробнее. Из предыдущих глав нам известно, что:
1) в периодической таблице химический элемент хлор расположен в основной подгруппе седьмой группы третьего периода под порядковым номером 17;
2) атом хлора имеет следующее строение:
3) молекула хлора имеет следующее строение: 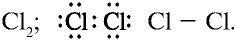
Получение:
В промышленности хлор получают путем электролиза.
В лабораторных условиях хлор получают при взаимодействии 
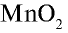
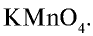
Физические свойства:
Хлор — таз желто-зеленого цвета с острым удушливым запахом, ядовит. Попадая в органы дыхания, хлор вызывает воспаление слизистой оболочки. Поэтому, работая с ним следует соблюдать осторожность. Примерно в 2,5 раза тяжелее воздуха. При температуре 20°С в одном объеме воды растворяется 2,5 объема хлора, в результате образуется раствор, называемый хлорной водой.
Определите массу хлора в хлорной воде.
Решение.
В одном объеме воды растворяется 2,5 объема хлора.
Значит, в 1 л воды растворяется 2,5 л
1. Масса 1 л воды: т — 1000 мл • 1 г/мл = 1000 г.
2. Масса 2,5 л 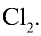
4. Масса раствора: 1000 + 7,9 = 1007,9 г.
5. Массовая доля хлора в растворе:
Химические свойства:
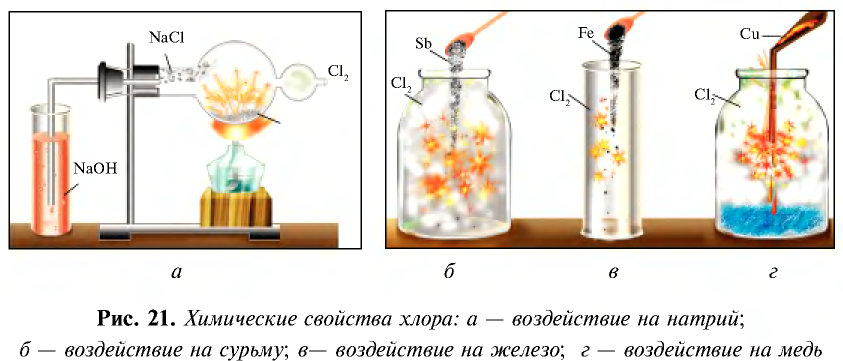
При взаимодействии с водородом, металлами, бромидами и йодидами хлор является окислителем. Например, реакция взаимодействия хлора с натрием выражается следующим уравнением (см. рис. 21, а).
Поскольку хлор сильный окислитель, то вступая в реакцию с железом, он окисляет его до степени окисления +3 (см. рис. 21, в).
Хлор взаимодействует также с сурьмой, медью и рядом простых веществ (рис. 21, б, г).
При взаимодействии с водой и щелочами один атом молекулы хлора является окислителем, второй—восстановителем:
Соединяясь с едким калием, хлор в зависимости от условий образует различные вещества. При взаимодействии хлора с нагретым едким калием образуются хлорид калия и бертолетова соль. Степень окисления хлора в хлориде калия равна —1, в бертолетовой соли +5:
При взаимодействии хлора с холодным едким калием образуются соли КС10 и КС1:
Уравняйте уравнение этой реакции методом электронного баланса.
Элементы знаний, умений и навыков: природные соединения хлора, получение, степени окисления хлора, хлор-окислитель, хлор-восстановитель, соляная кислота.
Хлорид водорода
Чем объясняются кислотные свойства водного раствора хлорида водорода?
Хлорид водорода — одно из самых важных соединений хлора. Его химическая формула НС1. Относительная молекулярная масса 36,5. Структурная формула Н—С1, атомы в молекуле связаны полярной ковалентной связью. Электронная формула 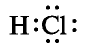
Получение:
1. В промышленности хлорид водорода получают в реакциях взаимодействия водорода и хлора:
2. В лабораторных условиях хлорид водорода получают путем воздействия на чистый сухой хлорид натрия концентрированной серной кислотой:
При сильном нагревании реакция заканчивается образованием сульфата натрия:
Физические свойства:
Хлорид водорода — бесцветный газ с острым удушливым запахом, немного легче воздуха 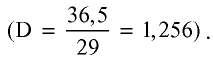
Химические свойства:
По химическим свойствам хлорид водорода схож с соляной кислотой, поэтому ее химические свойства рассмотрим подробнее ниже. Однако в отличие от соляной кислоты, сухой хлорид водорода не вступает в реакции с металлами и их оксидами.
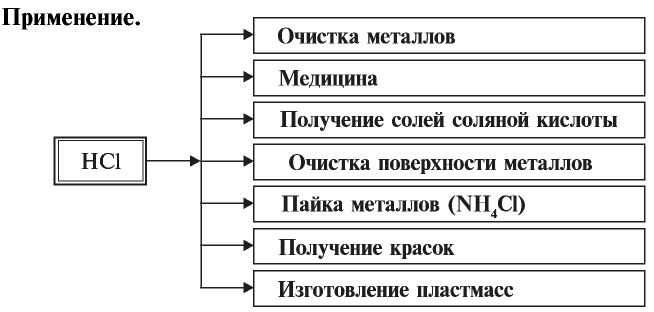
Применение:
Хлорид водорода используется в основном в производстве соляной кислоты.
Соляная кислота
Соляная кислота представляет собой водный раствор хлорида водорода.
Получение:
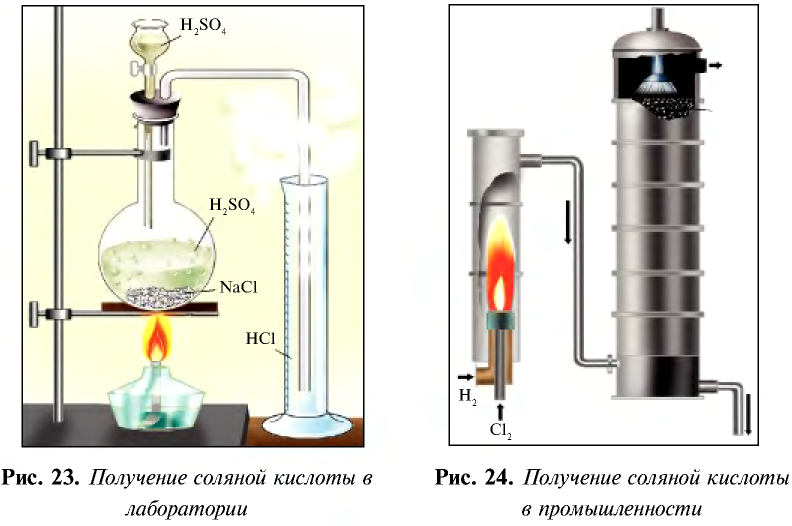
В лабораторных условиях соляную кислоту получают с помощью простой реакции. Выделяющийся в результате реакции газ направляется в воду, в которой он быстро растворяется и образует соляную кислоту (рис. 23).
В промышленности соляную кислоту получают путем сжигания водорода с хлором и растворения в воде полученного хлорида водорода (рис. 24).
Физические свойства:
Концентрированная соляная кислота — бесцветная жидкость с острым запахом (за счет выделения хлорида водорода), дымящаяся при влажном воздухе. Плотность концентрированной соляной кислоты 1,19 г/см3, содержание хлорида водорода в ней 37% (такая кислота называется также «дымящейся»).
Химические свойства:
1. Соляная кислота вступает в химические реакции, как и все сильные кислоты:
а) окрашивает фиолетовый цвет лакмуса в красный; обесцвечивает розовый цвет фенолфталеина в щелочной среде; изменяет оранжевый цвет метилоранжа в красный;
б) взаимодействует со всеми металлами, которые в ряду активности расположены перед водородом, с образованием соли и водорода:
в) взаимодействует с основными и амфотерными оксидами с образованием солей и воды:
г) взаимодействует с основаниями с образованием солей и воды:
д) взаимодействует с солями слабых кислот с образованием новой
2. Реакции, присущие соляной кислоте.
а) взаимодействует с нитратом серебра и образует белый осадок (AgCl), который не растворяется ни в воде, ни в кислоте:
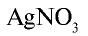
б) взаимодействует с окислителями, в результате чего ион хлора окисляется и образуется свободный хлор:
Соли соляной кислоты называют хлоридами. Хлориды имеют важное значение в народном хозяйстве.
Хлорид натрия (поваренная соль) — NaCl
Поваренная соль в природе встречается в большом количестве. Основная масса ее содержится в растворенном виде в воде морей и океанов. Поваренная соль встречается также в виде твердых кристаллов, называемых каменной солью. На территории Узбекистана каменная соль добывается на месторождениях Ходжаикан, Тубакат, Барса-Кельмес, Байбичакан, Аккала.
Температура кипения поваренной соли 1413°С, температура плавления 800,4°С, плотность 2,16 г/см3. Растворимость при 0°С — 35,6 г.
Поваренная соль имеет важное значение в жизни человека и в народном хозяйстве. Человек потребляет в сутки примерно 10 г, а в год — 3,6 кг поваренной соли. Значит, население Узбекистана в год потребляет примерно 90000 т поваренной соли. Население всего мира потребляет в год 25 млн т этого продукта.
Хлорид калия — КС1
Хлорид калия в природе встречается в виде минералов карналлита — 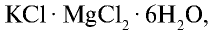
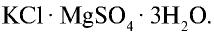
Хлорид калия имеет важное значение в производстве калийных удобрений для сельского хозяйства, а также для получения едкого кали, хлора и его соединений.
Почти все хлориды, кроме 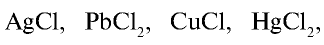
Для определения хлоридов и соляной кислоты используется раствор
Соль 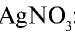
Кислородные соединения хлора
Галогены, в частности хлор, образуют ряд кислородных соединений, однако эти соединения получают косвенным путем, так как хлор непосредственно с кислородом не взаимодействует. В кислородных соединениях хлор проявляет степень окисления +1, +3, +5, +7.
Хлорноватистая кислота НСlO — неустойчивое вещество, которое существует только в разбавленных растворах.
НСlO — сильный окислитель. При медленном расщеплении ее выделяется атомарный кислород:
НСlO = НС1 + О.
Хлорноватистая кислота относится к очень слабым кислотам. Ее соли получают путем пропускания хлора через раствор щелочи:
При взаимодействии хлора с гашеной известью получают хлорную известь (отбеливающая известь):
Хлорная известь — 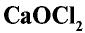
Хлористая кислота —
Хлорноватая кислота 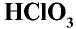
Хлорноватая кислота и ее соли — хлораты также являются сильными окислителями. При пропускании хлора через горячий гидроксид калия получается хлорат калия (бертолетова соль):
Бертолетова соль 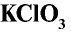
Хлорная кислота 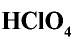
Элементы знаний, умений и навыков: хлорид водорода, соляная кислота, дымящаяся соляная кислота, реакции, присущие иону хлора, окисление хлор-иона, хлорноватистая кислота, хлорная известь, хлористая кислота, хлорноватая кислота, бертолетова соль, хлорная кислота.
Фтор, бром, йод
Какие соединения галогенов вы использовали? С какой целью?
Фтор, бром, йод являются представителями семейства галогенов и широко распространены в природе в виде различных соединений.
Фтор — в природе встречается в виде минералов флюорита (плавиковый шпат) 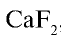
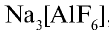
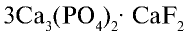
Бром — находится в виде минералов в морских и подземных водах и в качестве примеси во всех природных хлорсодержащих соединениях.
Йод — в природе встречается в составе морских водорослей, губок, морской воды в виде органических соединений и входит в состав чилийской селитры в качестве примеси в виде йодатов
Все галогены имеют острый запах и ядовиты. Молекулы 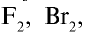
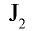
Фтор обладает очень высокой химической активностью и практически трудно растворим в растворителях. Бром и йод мало растворимы в воде и хорошо растворяются в органических растворителях.
При комнатной температуре фтор вступает во взаимодействие с щелочными металлами, свинцом и железом, а при накаливании реагирует также со всеми металлами, золотом и платиной. При низких температурах фтор взаимодействует с водородом, йодом, бромом, серой, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, при этом реакция сопровождается взрывом и воспламенением фтора. При накаливании фтор соединяется с хлором, криптоном и ксеноном:
Фтор не вступает непосредственно в реакцию с кислородом, азотом и алмазом, в атмосфере фтора стекло и вода сгорают:
Несмотря на относительно слабую химическую активность брома и йода, они также взаимодействуют со многими металлами и неметаллами.
Бром реагирует с водородом при небольшом нагреве, а с йодом при сильном нагревании, однако с повышением температуры нагрева
HJ начинает расщепляться и происходит обратная реакция, которая не доходит до конца:
Химические свойства галогенов ослабевают от фтора к астату, окислительные свойства снижаются поэтапно. Этим объясняется окисление легкими галогенами (в качестве простых веществ) ионов тяжелых галогенидов и восстановление оксидов легких галогенов ионами тяжелых галогенидов:
Так как фтор, бром, йод в природе встречаются в виде соединений и их ионы заряжены отрицательно, получение этих галогенов в свободном состоянии осуществляется через окисление их ионов путем воздействия окислителями и пропускания электрического тока через расплавы или водные растворы их солей.
Фтор используется для изготовления устойчивых к высоким температурам смазочных средств, стойких к химическим реагентам пластмасс (тефлон), охлаждающих жидкостей (фреон, хладон) и др.
Бром применяется при производстве различных лечебных средств, некоторых красок, при изготовлении бромида серебра. Недостаток брома в организме человека приводит к возникновению различных заболеваний нервной системы. При лечении этих заболеваний и при бессоннице применяются лекарственные средства на основе брома.
Пятипроцентный спиртовый раствор йода используется в медицине в качестве антисептического и кровоостанавливающего средства, а также при изготовлении ряда фармацевтических средств.
Пример №2
Как можно получить хлорид кальция с помощью поваренной соли и других необходимых веществ? Запишите соответствующие уравнения реакций.
Решение:
1) получение НС1 и 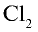
2) получение Са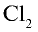
3) получение Ca 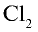
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.