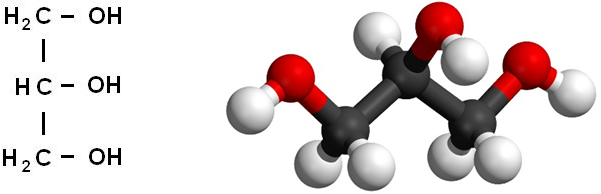
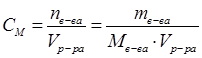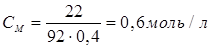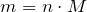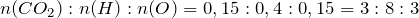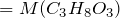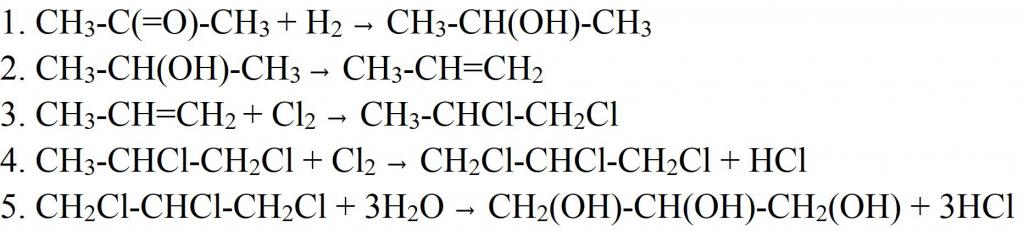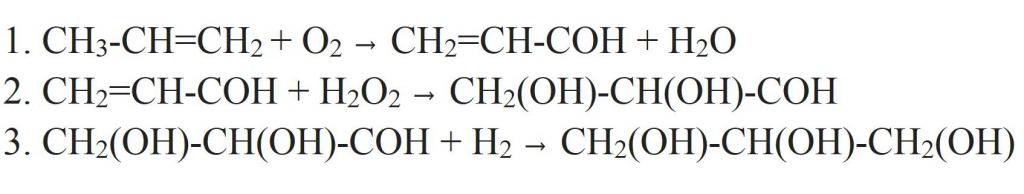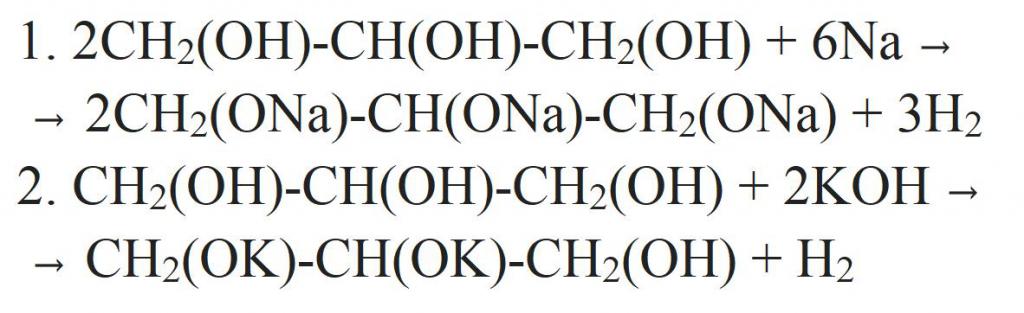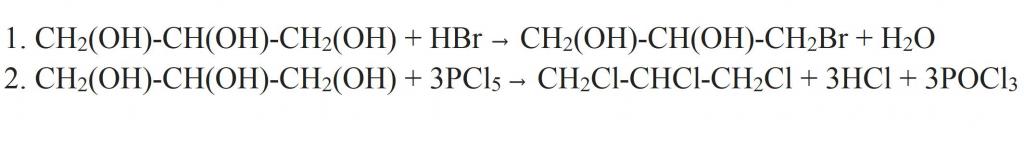Формула глицерина
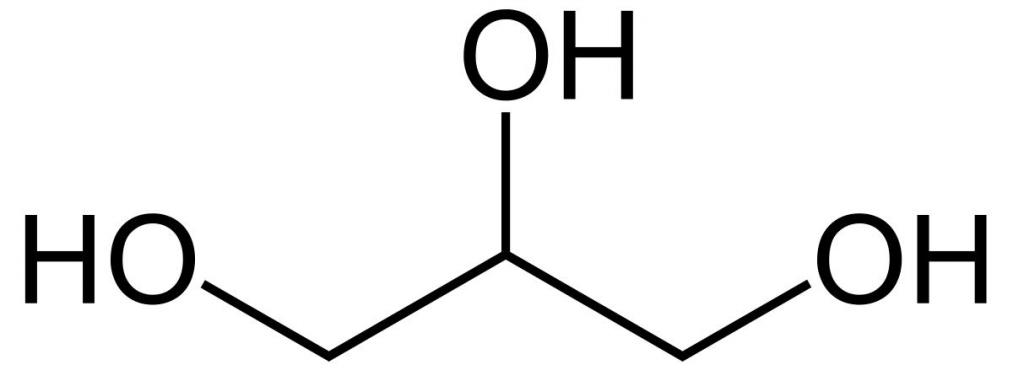
Химическая формула: HOCH2–CH(OH)–CH2OH
Рациональная формула: C3H5(OH)3
Структурная формула глицерина
Глицерин является простейшим представителем класса многоатомных спиртов – углеводородов, в молекулах которых несколько атомов водорода замещены на гидроксильные группы.
Общая формула трехатомных спиртов, к которым относится глицерин: CnH2n – 1(OH)3
Гидроксильные группы в молекулах многоатомных спиртов всегда связаны с разными атомами углерода, т.е с одним атомом углерода может быть связана только одна гидроксильная группа.
Процентное соотношение элементов в молекуле глицерина: водород – 8,756 %, углерод – 39,125 %, кислород – 52,119 %.
Физические свойства глицерина
При стандартных условиях глицерин – бесцветная или бледно-желтая жидкость, без запаха, сладкая на вкус. Температура плавления 17,8 °С. Температура кипения 290 °С. Плотность 1,2604 г/см
Химические свойства глицерина
Химические свойства глицерина во многом аналогичны свойствам одноатомных спиртов. Однако, следует учитывать, что гидроксильная группа – полярная частица, а атом кислород имеет неподеленную электронную пару. Наличие трех гидроксильных групп приводит к усилению поляризации связи О–С. На атомах углерода появляется частичный положительный заряд, который облегчает нуклеофильное замещение ОН-группы.
Поэтому многоатомные спирты в целом проявляют более кислые свойства, чем одноатомные спирты, в частности, взаимодействуют с образованием алкоголятов как с металлами, так и с гидроксидами тяжелых металлов.
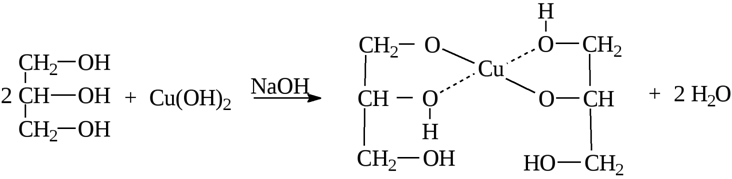
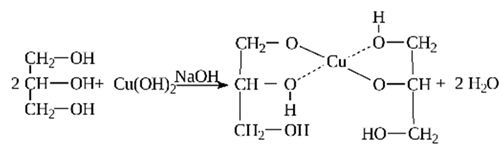
Качественная реакция на многоатомные спирты и, соответственно, на глицерин – взаимодействие с гидроксидом меди (II) с образованием ярко-синего глицерата меди (II):
Примеры решения задач по теме «формула глицерина»
| Задание | Рассчитать молярную концентрацию раствора, 400 мл которого содержат 22г глицерина. |
| Решение | Выражение для молярной концентрации раствора: |
Где nв-ва – количество растворенного вещества, моль; mв-ва – масса растворенного вещества, г; Мв-ва – молярная масса растворенного вещества, г/моль; Vр-ра – объем раствора, л.
Молярная масса глицерина равна:
М(глицерина) 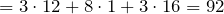
Молярная концентрация раствора будет равна:
| Задание | При сгорании органического вещества массой 4,6 г образовалось 3,36 л CO2 (н.у.) и 3,6г воды. Плотность паров органического вещества по водороду равна 46. Определить молекулярную формулу исследуемого вещества. |
| Решение | В состав продуктов горения входят только три элемента: углерод, кислород и водород. Понятно, что весь углерод из соединения перешел в CO2, а весь водород – в воду. Кислород присоединяется во время горения из воздуха, но также может содержаться в самом веществе. |
Рассчитаем элементный состав соединения.
Найдем количество продуктов реакции (моль):
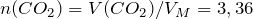
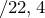
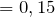
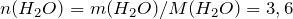
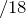
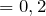
Следовательно, содержание углерода и водорода в исходном соединении равно:
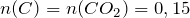
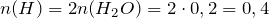
Рассчитаем их массы в исходном образце по формуле:
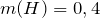
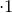
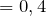
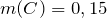
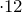
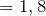
Определим, содержит ли исходное соединение кислород:
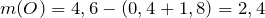
Найдем число моль кислорода:
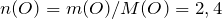
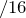
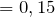
Соотношение числа атомов в молекуле соединения пропорционально их мольным долям:
Таким образом, простейшая формула исследуемого вещества C3H8O3. Ее молярная масса равна:
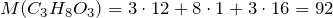
Проверим, является ли найденная формула истинной.
Рассчитаем молярную массу вещества, используя значение относительной плотности вещества по водороду:
M(в-ва) 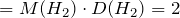
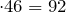
M(в-ва)
Следовательно, найденная формула является истинной.
Глицерин
Характеристики и физические свойства глицерина
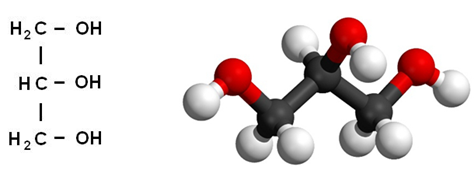
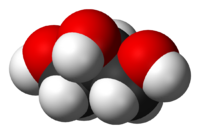
Его температуры плавления и кипения равны 18 o С и 290 o С соответственно. Глицерин гигроскопичен, хорошо смешивается с водой и этанолом. Абсолютно чистый безводный глицерин затвердевает при +18 o С, но получить его в твердом виде чрезвычайно сложно. Строение молекулы глицерина представлено на рис. 1.
Рис. 1. Строение молекулы глицерина.
Глицерин широко распространен в живой природе. Он играет важную роль в процессах обмена в организмах животных, входит в состав большинства липидов – жиров и других веществ, содержащихся в животных и растительных тканях и выполняющих в живых организмах важнейшие функции.
Получение глицерина
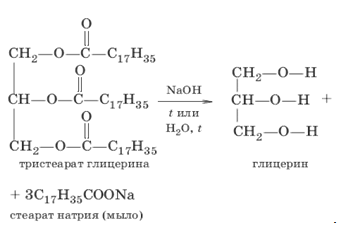
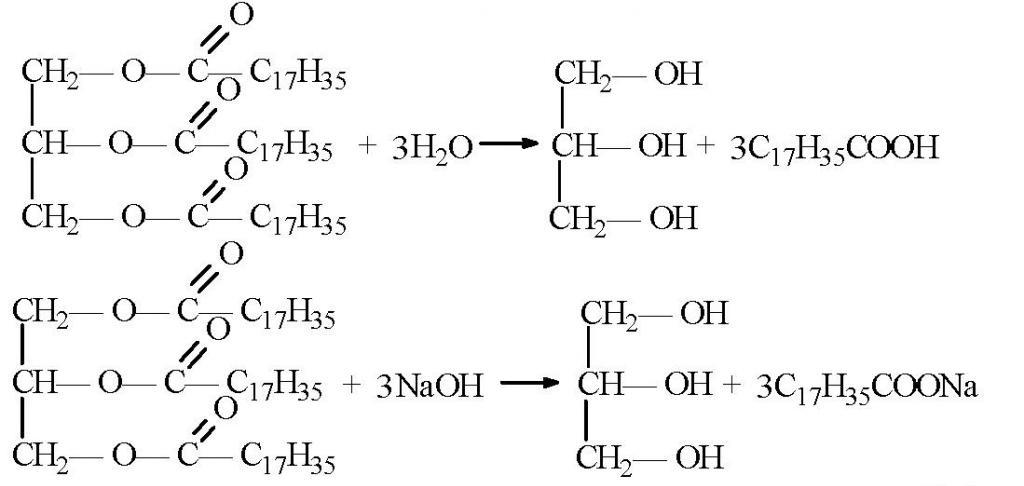
Старейший способ производства глицерина – гидролиз жиров и масел:
В настоящее время глицерин получают синтетическим путем из пропилена, образующегося при крекинге нефти. При этом используют разные пути превращения пропилена в глицерин. Наиболее перспективный способ – окисление пропилена кислородом воздуха в присутствии катализатора и при высокой температуре (kat = Cu, t 0 = 370). Процесс идет в несколько стадий.
Химические свойства глицерина
Глицерин является представителем трехатомных спиртов, для которых, как для гидроксилсодержащих соединений характерны те же реакции, что и для одноатомных спиртов.
Глицерин реагирует с активными металлами (калием, натрием и др.), замещающими водород во всех гидроксильных группах, вступают в реакции с галогеноводородами (HCl, HBr и др.), в реакции дегидратации, образуя различные эфиры.
Глицерин имеет и специфические свойства, отличающие его от одноатомных спиртов: он вступает в реакцию, не только со щелочными металлами, но и с некоторыми основаниями, в том числе нерастворимыми, например с гидроксидом меди (II):
Результатом реакции глицерина с гидроксидом меди (II) является глицерат меди (сложное комплексное соединение ярко-синего цвета). Эта реакция – качественная реакция на многоатомные спирты.
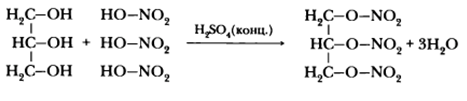
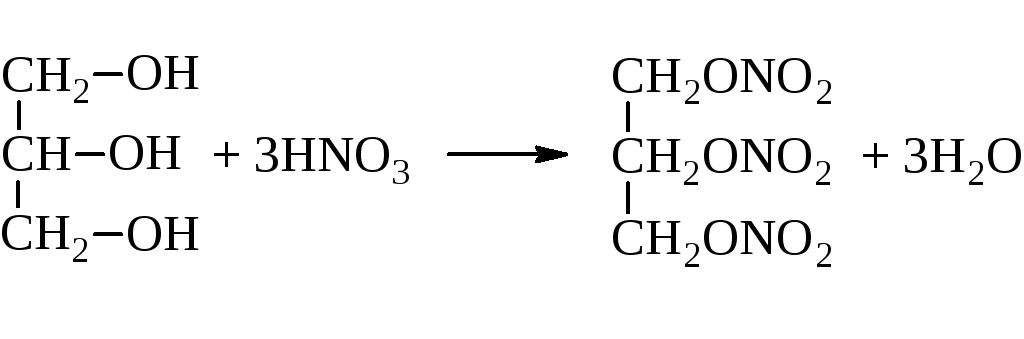
Важнейшей в практическом отношении является реакция нитрования глицерина, в результате которой образуется тринитроглицерин C3H5(ONO2)3:
Применение глицерина
Глицерин является компонентом многих пищевых продуктов, кремов и косметических средств.
Примеры решения задач
| Задание | С помощью каких реакций можно осуществить следующие превращения: |
Хлорэтан→ Этилен → 1,2-Дибромэтан → Этиленгликоль.
Реакция бромирования этилена, протекающая в среде неполярного инертного растворителя (наиболее часто для этой цели используют тетрахлорметан) по механизму электрофильного присоединения позволяет получить 1,2-дибромэтан:
При взаимодействии 1,2-дибромэтана с водным раствором щелочи происходит образование двухатомного спирта этиленгликоля:
| Задание | С помощью каких реакций можно осуществить следующие превращения: |
Глицерин → 1,2,3-Трихлорпропан → Глицерин → Нитроглицерин.
При взаимодействии 1,2,3-трихлорпропана с водным раствором щелочи происходит образование трехатомного спирта глицерина:
Взаимодействие глицерина с азотной кислотой в присутствии серной кислоты приводит к образованию нитроглицерина, являющегося основой динамита:
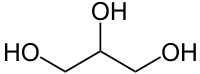
Глицерин: структурная формула, свойства и области применения
Это простейший трехатомный спирт. Химическая формула глицерина — C3H5(OH)3. Представляет собой прозрачную вязкую жидкость. Не имеет запаха, сладкий на вкус. Он не ядовит, поэтому находит широкое применение в быту, пищевой промышленности, косметике и медицине. Структурная формула глицерина представлена на рисунке. Но как добывают его?
Способы получения глицерина
Почти весь глицерин в промышленности получают из жиров. Они с химической точки зрения как раз и представляют собой сложные эфиры глицерина. При омылении этих жиров (получении мыла) глицерин образуется как побочный продукт. Затем он очень просто выделяется из реакционной смеси.
Синтезировать глицерин можно и другими способами. Например, из ацетона. В этом случае его восстанавливают водородом, чтобы получить изопропиловый спирт. На следующей стадии дегидратацией отщепляют молекулу воды, получая пропилен, который затем хлорируют. Полученный дихлорпропан хлорируют еще раз, для получения трихлорпропана. Последняя стадия получения глицерина — гидратация при нагревании. На этой стадии все три молекулы хлора заменяются на гидроксильные группы. Похожим способом сейчас в промышленности получают синтетическое вещество. Только в качестве сырья используют пропилен, который выделяется из побочных газов при перегонке нефти.
Но из пропилена получать глицерин можно и другим способом. Для этого пропилен окисляют в акролеин. Окисление ведется кислородом воздуха в присутствии катализатора (меди) и повышенной температуре. Далее к нему присоединяют перекись водорода, получая двухатомный спирт-альдегид. В качестве катализатора такой реакции используется оксид осмия (VIII). Альдегидную группу в полученном соединении гидрируют, превращая ее в третью гидроксильную. Так и получается глицерин.
Другой вариант синтеза в свое время предложил Е. Е. Вагнер. Окисляя аллиловый спирт перманганатом калия в щелочной среде, можно в одну стадию получить глицерин.
Физические свойства
Глицерин — бесцветная жидкость без запаха со сладковатым вкусом. Обладает гигроскопичностью, то есть стремится поглощать воду. При температуре 20 °C плавится, а при температуре 290 °C кипит с частичным разложением. Смешивается с водой и спиртами в любых соотношениях. Это обусловлено химической формулой. Гидроксильные группы позволяют глицерину образовывать множество водородных связей с молекулами воды. Это и обеспечивает растворение.
Химические свойства
Исходя из структурной формулы, глицерин содержит в себе три гидроксильные группы. Поэтому для него будут характерны и химические реакции одноатомных спиртов. Причем кислотные свойства глицерина выражены гораздо сильнее, чем у любого другого одноатомного спирта. Так, он может взаимодействовать с металлами, их оксидами или щелочами. Уравнения химических реакций глицерина представлены ниже.
Также он может вступать в реакции дегидратации, образуя множество разных продуктов. Таким образом получают акролеин.
Отдельно стоит сказать про замещение гидроксильной группы на галоген. Это может происходить при взаимодействии глицерина с галогеноводородами. Как видно из структурной формулы глицерина, в результате реакции могут образовываться моно-, ди- и трипроизводные. Более полного замещения можно добиться, если взаимодействие проводить с галогенидами фосфора.
Но глицерин имеет и специфичные свойства, присущие только многоатомным спиртам. Например, он взаимодействует с гидроксидом меди (II), образуя комплексное соединение синего цвета — глицерат меди. Это реакция является качественной для всех многоатомных спиртов.
Характеры для него и реакции этерификации. Это реакция взаимодействия с кислотами, в результате которой получается сложный эфир. Причем этерифицируется глицерин как органическими кислотами, так и минеральными. Например, азотной. Данную реакцию также называют нитрование. В результате нее получается очень полезный, но крайне взрывоопасный продукт — нитроглицерин. Опять же из структурной формулы глицерина видно, что этирифицироваться могут не все гидроксильные группы. Здесь все зависит от условий проведения реакции.
При взаимодействии с водородом при высоком давлении и в присутствии катализторов одна из гидроксильных групп восстанавливается. В результате реакции получается двухатомный спирт — пропиленгликоль.
Глицерин может вступать и в реакции поликонденсации, образуя смесь полиглицеринов. Для этого его очень долго нагревают почти до 300 °C в слабощелочной среде. Химическую формулу глицерина рассмотрели.
Окисление
Очень много у глицерина вариантов окисления. Конечный продукт зависит от природы окислителя, катализаторов и других условий реакции. Так, глицерин можно окислить сильными окислителями, например, дихроматом калия в кислой среде. В результате этой реакции весь глицерин разложится на углекислый газ и воду.
Окисление может происходить и более мягко. Например, при взаимодействии с перекисью водорода получается альдегид или кетон. В качестве катализатора используются соли железа (II).
Окисление можно вести и до получения глицериновой кислоты. В этом случае взаимодействие проводят с концентрированной азотной кислотой. Одна из гидроксильных групп просто окисляется до карбоксильной группы. Из глицерина получают и более экзотические кислоты. При взаимодействии с раствором перманганата калия образуются тартроновая и мезоксалевая кислоты. А при окислении кислородом воздуха с нагреванием в присутствии гидроксида бария получается смесь щавелевой и муравьиной кислоты. Йодной кислотой глицерин можно окислить до муравьиной и формальдегида.
Применение в промышленности
Благодаря своему составу и свойствам, находит глицерин применение в промышленности.
Применение в пищевой отрасли
Глицерин — это пищевая добавка Е422. Он используется в качестве стабилизатора для сохранения и увеличения вязкости продуктов. Его применяют в производстве хлебобулочных и кондитерских изделий (особенно шоколада) как загуститель и влагоудерживающий агент. Он помогает придавать объем готовым продуктам. Благодаря этой добавке хлеб может дольше оставаться свежим.
Экстракты на основе глицерина зачастую добавляют в напитки. Они позволяют сделать их вкус менее резким. Также его применяют в производстве алкоголя. Добавляют и в табак, чтобы регулировать влажность, устранять раздражающий привкус.
Применение в медицине
Глицерин входит в состав некоторых препаратов, которые используют при лечении кожных болезней. Он имеет антисептические свойства, препятствует заражению ран. Он также способствует понижению внутричерепного и внутриглазного давления, поэтому его применяют при лечении отека мозга.
Из-за того, что глицерин — хороший растворитель, его активно используют в фармакологической промышленности. С помощью этого вещества можно достигнуть очень высокой концентрации действующего компонента. Также он может придавать нужную консистенцию лекарствам. Его часто добавляют в мази и кремы, ведь тот препятствует выпариванию влаги и высыханию.
Применение в косметологии
Глицерин входит в состав многих косметических средств: мыл, шампуней, кремов, увлажняющих масок. При попадании на кожу в небольших количествах он удерживает влагу в верхних слоях кожи. Однако некоторые утверждают, что частое применение средств с глицериновой основой лишает кожу естественной влаги и лишь усугубляет сухость. Также глицерин часто используют как добавку в мыло. Так увеличивается его моющая способность.
Влияние на организм человека
Глицерин хорошо усваивается организмом, так как легко преобразуется в жиры пищеварительной системой. По этой причине он не считается токсичным. Суточное потребление этого вещества никак не ограничено. Но не стоит забывать, что глицерин гигроскопичен, поэтому в организме он приводит к большому выделению волы, то есть имеется риск наступления обезвоживания. По этой причине применение его в пищевых продуктах строго регламентируется. При попадании на кожу он также оказывает осушающий эффект. До сих пор ведутся споры о необходимости применении вещества в косметических средствах.
Итак, в статье рассмотрели состав и свойства глицерина, его применение.
Глицерин
| Глицерин | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | HOCH2-CH(OH)-CH2OH |
| Эмпирическая формула | C3H5(OH)3 |
| Физические свойства | |
| Молярная масса | 92,1 г/моль |
| Плотность | 1,261 г/см³ |
| Термические свойства | |
| Температура плавления | 18 °C |
| Температура кипения | 290 °C |
| Оптические свойства | |
| Показатель преломления | 1,4729 |
| Классификация | |
| Рег. номер CAS | 56-81-5 |
| SMILES | OCC(O)CO |
Глицери́н (1,2,3-тригидроксипропан; 1,2,3-пропантриол) (гликос — сладкий) химическое соединение с формулой HOCH2CH(OH)-CH2OH или C3H5(OH)3. Простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость.
Содержание
Физические свойства
Глицерин — бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества.
Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислотами с образованием соответствующих эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканьо Собреро), использующийся в настоящее время в производстве бездымных порохов.
HOCH2CH(OH)-CH2OH 
и окисляется до глицеринового альдегида СН2ОНСНОНСНО, дигидроксиацетона СН2ОНСОСН2ОН или глицериновой кислоты СН2ОНСНОНСООН.
Эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Получение
Глицерин впервые был получен в 1779 году Шееле при омылении жиров в присутствии окислов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500° С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, CH2ClCHOHCH2Cl, которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 60—70 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров.
Глицерин и триглицериды
Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Глицерин используется как пищевая добавка Е422 в производстве кондитерских изделий для улучшения консистенции, для предотвращения проседания шоколада, увеличения объёма хлеба.
Технический глицерин используется для заполнения виброустойчивых манометров типа ДМ8008ВУ, заполнения торцевых уплотнений мешалок и др.
См. также
Примечания
Ссылки
На русском и английском языках:
На английском языке:
Полезное
Смотреть что такое «Глицерин» в других словарях:
ГЛИЦЕРИН — (греч., от glykys сладкий). Бесцветная сиропообразная жидкость сладкого вкуса, получаемая при производстве стеарина от разложения жиров при их обмыливании. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ГЛИЦЕРИН… … Словарь иностранных слов русского языка
ГЛИЦЕРИН — прозрачная, бесцветная, вязкая жидкость сладкого вкуса; хорошо смешивается с водой и спиртом. Обладает способностью обезвоживать кожу, поэтому для смягчения кожи глицерин применяется в разведённом виде. Неразведённый глицерин можно втирать только … Краткая энциклопедия домашнего хозяйства
глицерин — а, м. glycérine f., нем. Glyzerin. Составная часть всех жиров, густая, сладкая, растворимая в воде жидкость. Получается при перегонке сала в стеариновом производстве. Употребляется для приготовления нитроглицерина, динамита, в фотографии, для… … Исторический словарь галлицизмов русского языка
ГЛИЦЕРИН — Glycerinum. Трехатомный алкоголь. С3Н5(ОН)3. Получают из растительных и животных жиров путем омыления их растворами едких щелочей или при воздействии перегретым паром. Также синтезируют из пропилена. Свойства. Глицерин бесцветная, прозрачная, си … Отечественные ветеринарные препараты
глицерин — Глицерин представляет собой сиропообразную сладковатую на вкус жидкость, не имеющую запаха и цвета. Он входит в состав всех натуральных жиров. При украшении тортов его используют для придания пластичности яичной глазури (смесь яичных белков … Кулинарный словарь
ГЛИЦЕРИН — (от греческого glykeros сладкий), CH2(OH)CH(OH)CH2OH, бесцветная горючая вязкая жидкость сладкого вкуса, tкип 290шC. Эфиры глицерина глицериды основа жиров. Глицерин сырье в производстве нитроглицерина, алкидных (глифталевых) смол, полиуретанов,… … Современная энциклопедия
ГЛИЦЕРИН — (1, 2, 3 триоксипропан, НОСН2СН (ОН) СН2ОН), сладкая сиро пообразная жидкость, которую получают из жиров растительного и животного происхождения, пропилена, а также масел. Используется при изготовлении мыла. Глицерин добавляют в пластмассу,… … Научно-технический энциклопедический словарь
ГЛИЦЕРИН — ГЛИЦЕРИН, глицерина, мн. нет, муж. (от греч. glykeros сладкий). Сладкая сиропообразная прозрачная жидкость, добываемая из жиров для медицинских, гигиенических и технических целей. Глицерин побочный продукт при производстве стеарина и при… … Толковый словарь Ушакова
ГЛИЦЕРИН — ГЛИЦЕРИН, из жиров химически извлеченный продукт. Глицериновое мыло (Наумов). Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Глицерин — (от греческого glykeros сладкий), CH2(OH)CH(OH)CH2OH, бесцветная горючая вязкая жидкость сладкого вкуса, tкип 290°C. Эфиры глицерина глицериды основа жиров. Глицерин сырье в производстве нитроглицерина, алкидных (глифталевых) смол, полиуретанов,… … Иллюстрированный энциклопедический словарь
Теперь вы знаете какие однокоренные слова подходят к слову Глицерин как пишется в химии, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Глицерин как пишется в химии", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.