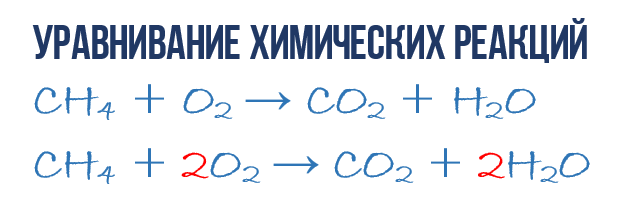Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
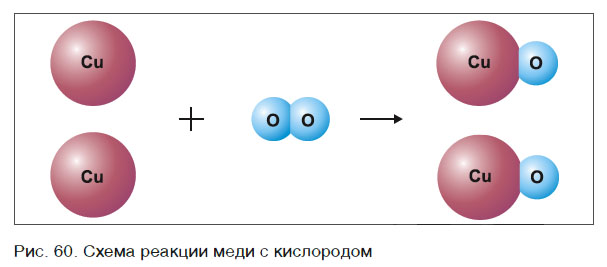
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
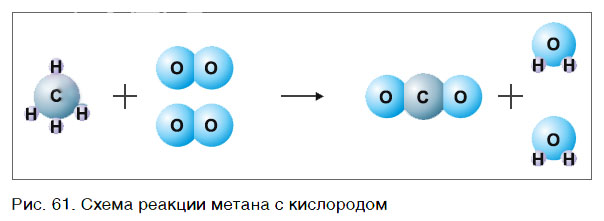
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Как написать уравнение реакции по химии 9 класс
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
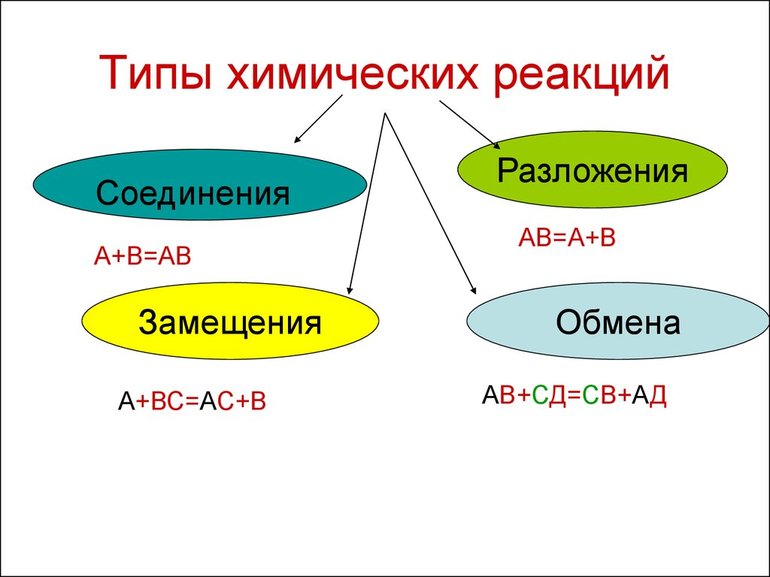
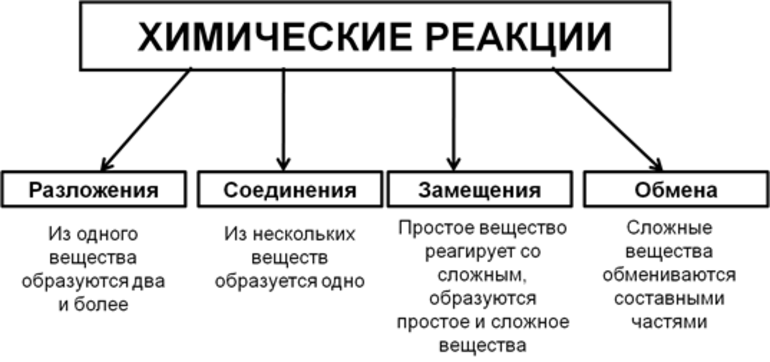
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Основные термины и понятия
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
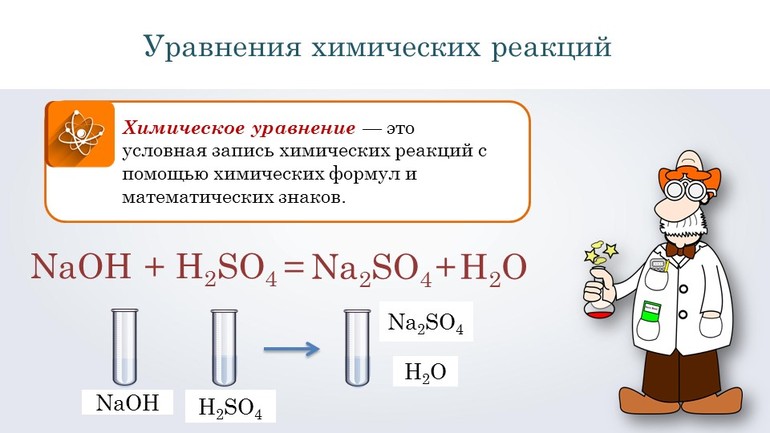
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.

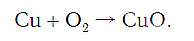
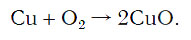
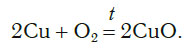
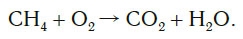
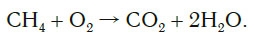
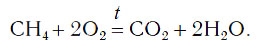
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)