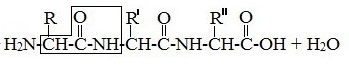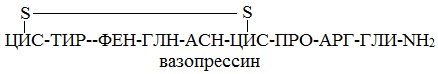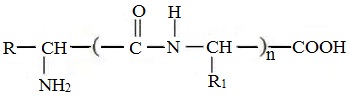Как написать формулу пептида
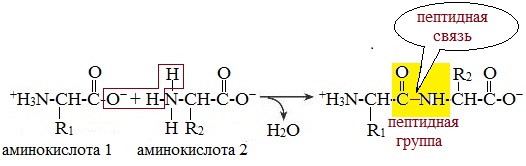
На рис. 4.1 изображен трипептид, состоящий из аминокислотных остатков аланина, цистеина и валина. Отметим, что трипептид содержит три остатка, но не три пептидные связи.
Рис. 4.1. Структурная формула трипептида. Пептидные связи для наглядности затенены.
Запись структурной формулы пептидов
Укажем самый простой способ записи. Во-первых, нарисуем «остов» из связанных друг с другом 
1. Вычертим зигзагообразную линию произвольной длины и добавим слева N-концевую аминогруппу:
2. Встроим в цепочку а-углеродные атомы, а-карбоксильную и а-аминную группы:
3. Присоединим соответствующие 
Рис. 4.2. Представление первичной структуры гексапептида с помощью трехбуквенных и однобуквенных обозначений аминокислотных остатков. Данный гексапептид содержит на N-конце глутамат (Glu. Е). а на С-конце аланин
Первичная структура пептида
Линейная последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой пептида. Чтобы определить первичную структуру Полипептида, нужно установить число, химическую структуру и порядок расположения всех аминокислотных остатков, входящих в его состав.
Полипептиды (белки) могут содержать 100 и более остатков, поэтому традиционные структурные формулы оказываются неудобными для представления первичной структуры. «Химическая скоропись» использует либо трехбуквенные, либо однобуквенные обозначения аминокислот, выписанные во втором столбце табл. 3.3 (рис. 4.2). При наименовании пептида его рассматривают как производное С-концевого аминокислотного остатка.
Если первичная структура однозначно установлена, то трехбуквенные обозначения аминокислотных остатков соединяют черточками. Однобуквенные обозначения черточками не соединяют. Если на каком-то участке полипептидной цепи точный порядок следования аминокислотных остатков неизвестен, эти остатки заключают в скобки и разделяют запятыми (рис. 4.3).
Рис. 4.3. Гептапептид, содержащий участок, точная первичная структура которого не установлена.
Физиологические последствия изменений в первичной структуре
Замена всего одной аминокислоты на другую в линейной последовательности из 100 и более аминокислот может привести к снижению или полной потере биологической активности пептида, а это повлечет за собой весьма серьезные последствия (в качестве примера можно привести серповидноклеточную анемию; см. гл. 6). Многие наследуемые нарушения метаболизма обусловлены именно одиночными заменами такого типа. С развитием новых мощных методов определения структуры белков и ДНК удалось выяснить биохимическую основу многих наследуемых болезней, связанных с нарушениями метаболизма.
Схема В. Номенклатура пептидов. При написании формул пептидов необходимо:
При написании формул пептидов необходимо:
· выделять пептидные связи,
· указывать N- и С-концы пептида,
· уметь строить полное и краткое название пептида
· указывать характер среды в водном растворе данного пептида.
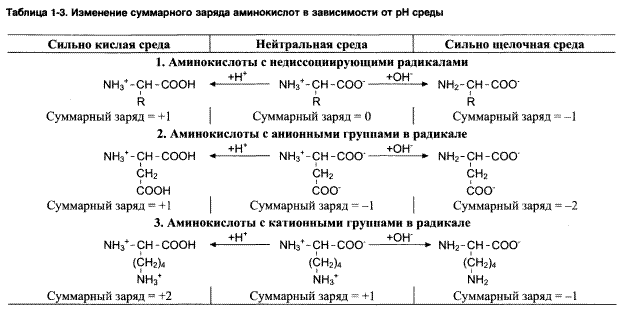
Расчет изоэлектрической точки моноаминомонокарбоновых кислот осуществляется по формуле:
Значения pK карбоксильной и аминогруппы, а также дополнительных ионогенных групп, содержащихся в радикале, представлены в таблице 1.2
Таблица 1.2 Величины рК ионизированных групп некоторых аминокислот (25 0 С)
| Аминокислота | рК1, α-СООН | рК2, α-NH 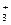 | рК3, R-группа |
| Аланин | 2,34 | 9,69 | – |
| Аргинин | 2,17 | 9,04 | 12,48 (гуанидин) |
| Аспарагин | 2,02 | 8,80 | – |
| Аспарагиновая кислота | 2,09 | 9,82 (NH 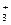 ) ) | 3,86 (СООН) |
| Валин | 2,32 | 9,62 | – |
| Гистидин | 1,82 | 9,17 (NH 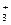 ) ) | 6,0 (имидазол) |
| Глицин | 2,34 | 9,60 | – |
| Глутамин | 2,17 | 9,13 | – |
| Глутаминовая кислота | 2,19 | 9,67 (NH 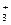 ) ) | 4,25 (СООН) |
| Изолейцин | 2,36 | 9,68 | – |
| Лейцин | 2,36 | 9,60 | – |
| Лизин | 2,18 | 8,95 | 10,53 (ε-NH 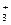 ) ) |
| Метионин | 2,28 | 9,21 | – |
| Оксипролин | 1,92 | 9,73 | – |
| Пролин | 1,99 | 10,96 | – |
| Серин | 2,21 | 9,15 | – |
| Тирозин | 2,20 | 9,11 | 10,07 (ОН) |
| Треонин | 2,71 | 9,62 | – |
| Триптофан | 2,38 | 9,39 | – |
| Цистеин | 1,71 | 8,33 | 10,28 (SH) |
Пример 1: рассчитайте значение ИЭТ аминокислоты аланина.
Пример 2: рассчитайте суммарный заряд аланина при рН равном 1,5 7,0 и 11,0. Определите направление перемещения аминокислоты под действием электрического поля в указанных условиях.
При значении рН > рI аминокислоты превращаются в анион, имеют отрицательный заряд и под действием электрического поля перемещаются в сторону анода.
Следовательно, при рН 1,5 аланин является катионом и под действием электрического поля перемещаются в сторону катода. При рН 7,0, близком к значению рI данной аминокислоты, суммарный заряд равен 0. Аминокислота электрофоретически неподвижна. При рН 11,0 аланин является анионом и под действием электрического поля перемещаются в сторону анода.
В случае аминокислот, имеющих дополнительные ионогенные группы в радикале, для расчета суммарного заряда молекулы при данных условиях, значения рК каждой ионогенной группы сопоставляются со значением рН раствора:
— для групп, диссоциирующих по кислотному типу, диссоциацией практически пренебрегают, если рН рК
Как написать формулу пептида
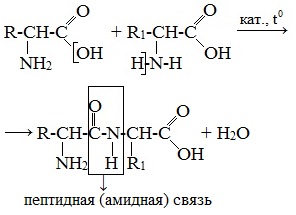
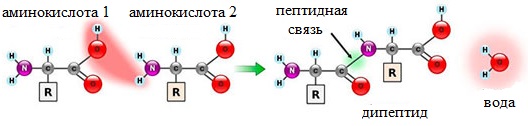
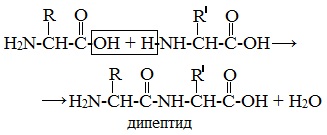
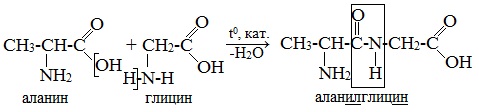
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот.
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.
Образование дипептидов
Две аминокислоты образуют дипептид:
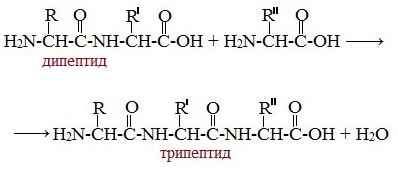
Образование трипептидов
Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Полученное соединение называется трипептидом.
Процесс наращивания пептидной цепи может продолжаться неограниченно и приводит к веществам с очень высокой молекулярной массой (белкам).
Формулы пептидов обычно записываются так, что свободная аминогруппа находится слева, а свободная карбоксильная группа – справа. Основная часть пептидной цепи построена из повторяющихся участков –СН-СО-NН- и боковых групп R, R’ и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений.
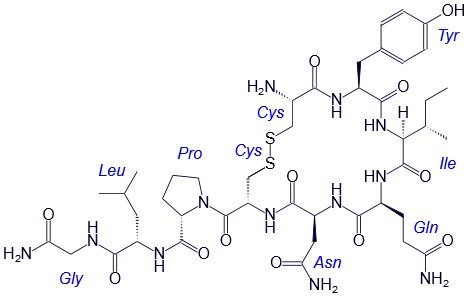
Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
В этом пептиде остатки цистеина связаны дисульфидными мостиками. Правый конец цепи содержит амидную группу –СО-NН2 вместо карбоксильной.
Номенклатура
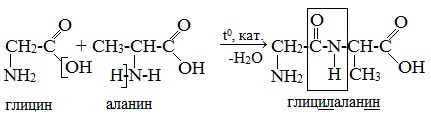
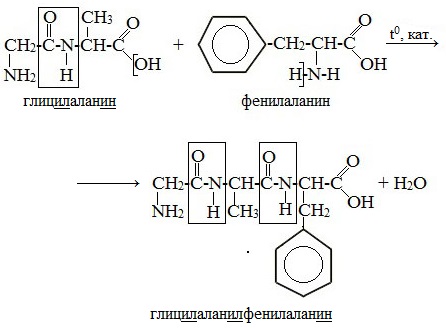
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH2.
Любой дипептид имеет свободные амино- и карбоксильную группы и поэтому может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид. Таким же путем получают тетрапептиды и т.д.
Биологическое значение
Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты.
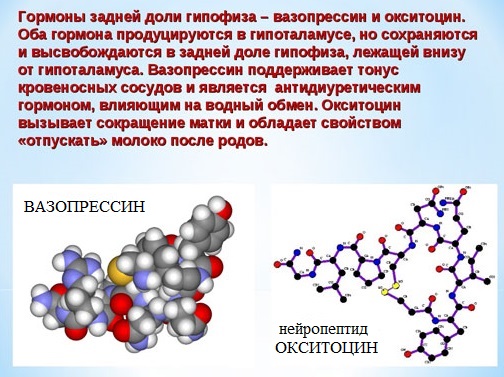
Некоторые пептиды (окситоцин, вазопрессин, инсулин) имеют огромное биологическое значение, являются важными гормонами.
Вазапрессин и окситоцин содержат 9 аминокислотных остатков.
Вазопрессин вырабатывается гипофизом и стимулирует сокращение кровеносных сосудов, повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
Инсулин – биологически важный пептид, который построен из двух цепей, состоящих из 21 и 30 α-аминокислотных остатков, которые связаны между собой дисульфидными мостиками. Вырабатывается поджелудочной железой и снижает содержание сахара в крови.
Химические свойства
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь.
Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот.
Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенный участки пептидной цепи. Селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Как написать формулу пептида
!) Аммонолиз галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве реагента применяют смесь NaCN и NH4Cl.
3) Алкилирование N-фталимидмалонового эфира
5) Из оксимов циклических кетонов перегруппировкой Бекмана.
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением.
2.1. Кислотно-основные свойства
Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН, строго определенном для каждой аминокислоты, она существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической точкой (рI). В изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты содержит два кислотных центра (COOH и NH3 + ) и характеризуется двумя константами диссоциации рКа1 и рКа2. Значение рI определяется по уравнению:
2.2. Реакции по аминогруппе
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.
Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и арилирование
При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце.
Реакция используется для установления аминокислотной последовательности в пептидах.
Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно, гидролизуются в жестких условиях. При разработке методов синтеза пептидов были найдены защитные группы, которые легко удаляются путем гидролиза или гидрогенолиза.
трет-Бутоксикарбонильная защита (БОК-защита).
Легкость снятия защиты обусловлена устойчивостью бензил- и трет-бутил-катионов, которые образуются в качестве интермедиатов.
2.3. Реакции по карбоксильной группе
При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов.
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и ангидридов
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в синтезе пептидов.
2.4. Специфические реакции аминокислот
Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
Отношение аминокислот к нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
Реакция используется для количественного анализа аминокислот методом фотометрии.
3.1. Строение и классификация
Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу).
Аминокислоты, содержащие неполярный радикал R
Аминокислоты, содержащие полярный неионогенный радикал R
Аминокислоты, содержащие полярный положительно заряженный радикал R
Аминокислоты, содержащие полярный отрицательно заряженный радикал R
Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.
В белках ионогенные группы этих аминокислот располагаются, как правило, на поверхности молекулы и обуславливают электростатические взаимодействия.
Природные аминокислоты относятся к L-ряду.
Большинство аминокислот содержат один хиральный центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера, из которых только один встречается в составе белков.
Так, из 4-х стереоизомеров треонина в природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только одного вида стереоизомеров имеет важное значение для формирования их пространственной структуры и обеспечения биологической активности.
Сначала рацемическую аминокислоту ацилируют уксусным ангидридом:
Затем рацемическую смесь ацетильных производных подвергают ферментативной обработке. При этом гидролизуется ацетильное производное только L-аминокислоты:
Полученная после ферментативного смесь легко разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные свойства.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Нейтральные аминокислоты не содержат в радикале R дополнительных кислотных или основных центров, способных к ионизации в водной среде. В кислой среде они существуют в виде однозарядного катиона и являются двухосновными кислотами по Бренстеду. Как видно на примере аланина, изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале 5,5 – 6,3.
Основные аминокислоты содержат в радикале R дополнительный основный центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
Кислые аминокислоты содержат в радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (
7) ни одна аминокислота не находится в изоэлектрической точке. В организме все аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах используется для разделения аминокислот методом электрофореза и ионообменной хроматографии. При данном значении рН разные аминокислоты могут иметь разный по величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а аланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут быть разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной хроматографии используют катионообменные смолы (сульфированный полистирол). Процесс ведут в кислой среде, когда аминокислоты находятся катионной форме.
Скорость продвижения аминокислот по хроматографической колонке зависит от силы их электростатических и гидрофобных взаимодействий со смолой. Наиболее прочно связываются со смолой основные аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты с неполярными боковыми радикалами, особенно ароматическими. Таким образом, порядок элюирования аминокислот следующий. Легче других элюируются кислые аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
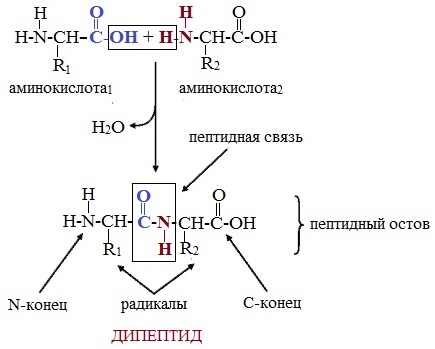
Аминокислотные остатки в пептиде связаны амидными (пептидными) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.
Пептид характеризуется аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
4.2. Определение аминокислотной последовательности
Для определения аминокислотной последовательности используют комбинацию двух методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой аминокислоты пептид не разрушается и операцию по отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с образованием более коротких цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют пептидные связи избирательно, например, только с N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы). Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
Синтез пептида с заданной аминокислотной последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов.
В настоящее время разработана стратегия синтеза пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие стадии:
Таким образом, последовательно присоединяя аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает низкий выход конечного продукта. Основные потери связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее время твердофазный синтез пептидов. На первой стадии защищенная по аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном введением групп –CH2Cl). После снятия защиты проводят ацилирование аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая содержит активированную карбоксильную и защищенную аминогруппу. После снятия защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с носителя действием бромистоводородной кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов – автоматических синтезаторов.
Методом твердофазного синтеза получено большое количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка).