Нитрат натрия
| Нитрат натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат натрия |
| Традиционные названия | Натриевая селитра |
| Химическая формула | NaNO3 |
| Физические свойства | |
| Отн. молек. масса | 84,99 а. е. м. |
| Плотность | 2,257 г/см³ |
| Термические свойства | |
| Температура плавления | 308 °C |
| Температура разложения | 380 °C |
| Безопасность | |
| Токсичность | соединение не токсично |
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Содержание
Свойства
Физические свойства
Химические свойства
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
Также вместо азотной кислоты можно использовать нитрат аммония:
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Нитрат натрия ГОСТ 828-77
Содержание
Свойства
Физические свойства
Растворимость (г в 100 г) в:
Химические свойства
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
NaNO3 + KCl ⟶ KNO3 + NaCl NaNO3 + RbI ⟶ RbNO3 + NaI
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
Также вместо азотной кислоты можно использовать нитрат аммония:
Применение
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Формула нитрата натрия
Определение и формула нитрата натрия
Плавится без разложения, но разлагается при дальнейшем нагревании. Хорошо растворяется в воде (не гидролизуется). Кристаллогидратов не образует. Практически не растворяется в концентрированной азотной кислоте. Сильный окислитель при спекании.
Рис. 1. Нитрат натрия. Внешний вид.
Химическая формула нитрата натрия
Химическая формула нитрата натрия NaNO3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества (Ar(Na) =23а.е.м., Ar(N) = 14 а.е.м., Ar(O) = 16 а.е.м.):
Mr(NaNO3) = 23 + 14 + 3×16 = 23 + 14 + 48 = 85.
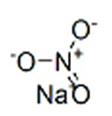
Структурная (графическая) формула нитрата натрия
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Ниже представлена графическая формула нитрата натрия:
Ионная формула
Нитрат натрия электролит, поэтому он способен диссоциировать в водном растворе на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде: |
Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа:
n(CO2) = 5,6 / 22,4 = 0,25 моль.
Рассчитаем молярную массу предельной одноосновной кислоты:
Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода, 1 – для водорода и 16 для кислорода):
M(CnH2n+1COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46;
14n + 46 = 102 г/моль;
Значит молекулярная формула предельной одноосновной кислоты C4H9COOH.
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде: |
Рассчитаем количество вещества хлороводорода:
n(HCl) = 1,2 / 22,4 = 0,05 моль.
Согласно уравнению реакции n(HCl): n(CnH2n) = 1:1, т.е. n(CnH2n) = n(HCl) = 0,05 моль.
Рассчитаем молярную массу алкена:
Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода и 1 – для водорода):
Значит молекулярная формула алкена C4H8.
Нитрат натрия, характеристика, свойства и применение
Нитрат натрия, характеристика, свойства и применение.
Нитрат натрия – неорганическое вещество, имеет химическую формулу NaNO3.
Краткая характеристика нитрата натрия:
Нитрат натрия – неорганическое вещество белого цвета.
Химическая формула нитрата натрия NaNO3.
Нитрат натрия – неорганическое химическое соединение, соль азотной кислоты и натрия.
Хорошо растворяется в воде, жидком аммиаке, перекиси водорода. Плохо растворим в этаноле, метаноле. Не растворим в ацетоне.
Гигроскопичен. Кристаллогидратов не образует.
Нитрат натрия токсичен, по степени воздействия на организм человека относится к умеренно опасным веществам (3-й класс опасности по ГОСТ 12.1.007).
Наиболее крупные месторождения природного нитрата натрия находятся в Чили и Перу.
В пищевой промышленности нитрат натрия зарегистрирован как пищевая добавка Е251 и используется как консервант и фиксатор окраски. В некоторых странах нитрат натрия запрещен как пищевая добавка.
Физические свойства нитрата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaNO3 |
| Синонимы и названия иностранном языке | sodium nitrate (англ.) |
натрий азотнокислый (рус.)
Химические свойства нитрата натрия. Химические реакции нитрата натрия:
Описание нитрата натрия и химическая формула селитры, правила применения
Нитратом натрия называют подкормку, которая отличается выраженными щелочными характеристиками и сильной окислительной активностью. Ее также называют азотнокислым натрием или натриевой селитрой. Состав часто применяется в сельском хозяйстве для улучшения структуры грунта. Благодаря этому он становится пригоден для культивации различных растений. При этом важно применять состав правильно.
Описание вещества
Какие физические свойства проявляет
Нитрат натрия – это далеко не единственное название вещества. Для обозначения этого средства часто применяют такие понятия, как «натриевая селитра» или «азотнокислый натрий». Также его нередко называют чилийской селитрой.
Сегодня соль обычно получают в качестве побочного продукта, который формируется вследствие получения азотной кислоты из аммиака. Удобрение легко смешивается с обычной водой. По мере повышения температуры растворимость увеличивается. При +20 градусах в 100 миллилитрах воды растворяется 87,6 грамма порошка, а при +100 градусах – 176 граммов.
Основные химические свойства
Формула натриевой селитры – NaNO3. Вещество поглощает из воздуха влагу, потому оно сильно слеживается. При этом наблюдаются структурные изменения, а мелкие кристаллы – превращаются в большие. В сухом помещении соль не слеживается и сохраняет свою рассыпчатость. Именно в таком виде ее проще всего вносить в грунт.
В земле азотнокислый натрий распадается на катион Na+ и анион NO3-. Нитрат ион усваивается исключительно биологическим способом. Это происходит осенью и зимой. Однако в силу отсутствия биологического поглощения вещество не остается в почве. Это приводит к потерям азота, особенно на легких по структуре типах почвы. Эта особенность не позволяет применять состав для внесения осенью. При необходимости предзимнего внесения дозировку повышают.
Главная польза и возможный вред
Вещество приносит растениям и грунту большую пользу. К его главным преимуществам относят следующее:
Недостатком вещества считается невозможность его применения в осеннее время года. В этом случае оно легко вымывается и не приносит пользы.
Где применяется
Лишь определенный класс натриевой селитры может применяться в сельском хозяйстве, а именно – СХ. В качестве добавки к составу для удобрений запрещено применять марку А. Ее главным назначением считаются химическая, стекольная, металлообрабатывающая отрасли промышленности. Класс Б обладает свойствами нитрата натрия. Они будут полезны для грунта и растений, однако основным назначением этого вида селитры считается осветление стекол и травление металлов.
Чтобы применение вещества приносило настоящую пользу, требуется четко соблюдать инструкцию и выполнить тест на наличие нитратов.
При использовании состава важно учитывать, что он представляет собой сильный окислитель. Потому сочетать его вещество с некоторыми препаратами нельзя.
Можно ли приготовить натриевую селитру самостоятельно
Чтобы сделать препарат своими руками, рекомендуется взять такие компоненты:
Для приготовления подкормки стоит сделать следующее:
Не стоит заниматься приготовлением средства в закрытом помещении. Испарения аммиачной селитры плохо выветриваются и могут оседать на предметах интерьерах. В результате человек будет получать систематическое отравление. Готовить состав рекомендуется на свежем воздухе. При этом важно периодически отходить от емкости с кипящим составом.
Правила использования
Нитрат натрия можно вносить под любые растения. Исключением считаются лишь те культуры, которые не требуют большого количества натрия в качестве питательного вещества. На дозировку влияет количество азота в почве, погода, климат, разновидность растения.
Норму натриевой селитры на 1 квадратный метр требуется в каждом конкретном случае рассчитывать индивидуально:
При использовании натриевой селитры в личных подсобных хозяйствах ее стоит вносить под перекопку осенью – по 1-2 килограмму на сотку. Весной рекомендуется использовать по 500 граммов вещества на 1 сотку.
Для кустарников требуется 60 граммов средства на 1 лунку. Также разрешается распределять порошок в приствольных кругах. В этом случае на 1 квадратный метр рекомендуется использовать по 15-30 граммов средства. На 1 взрослое дерево максимальная дозировка составляет максимум 250 граммов.
Существуют ли противопоказания и срок годности
Нитрат натрия не стоит использовать на солончаках или в засоленном грунте. В этом случае рекомендуется выбрать другой препарат с аналогичными свойствами. При комбинированном применении вещество нельзя сочетать с перегноем и средствами на основе фосфора и калия. Также препарат запрещено применять в телицах.
Срок хранения натриевой селитры не ограничен. Ее разрешается держать исключительно в заводской упаковке, которая не пропускает влагу. Нельзя хранить рядом органические подкормки, пищевые продукты и бытовые средства. Помимо этого, вещество должно находиться вне зоны доступа детей и домашних животных.
При нагревании подкормки есть вероятность взрыва или возгорания. Потому препарат требуется изолировать от горючих средств и герметично закрыть. Мешки с порошком должны находиться на поддонах.
Техника безопасности и первая помощь при интоксикации
При попадании нитрата натрия на кожу есть риск ее раздражения. Чтобы избежать подобных проблем, при работе с веществом требуется использовать резиновые перчатки. После завершения процедур руки рекомендуется тщательно вымыть.
Немаловажное значение имеет использование очков и респиратора. Нитрат натрия вреден для людей. Он может представлять серьезную опасность при вдыхании и попадании на слизистые оболочки. Пыль оказывает раздражающий эффект и может стать причиной ожога.
При отравлении натриевой селитрой появляются такие признаки:
При появлении таких симптомов следует сразу обратиться к врачу. В качестве первой помощи пострадавшего требуется вывести на свежий воздух и переодеть. Кожу и глаза рекомендуется тщательно промыть холодной водой. При попадании вещества в желудок требуется сделать промывание. Для этого нужно принять 6-7 таблеток активированного угля и запить водой. Через 20 минут рекомендуется спровоцировать рвоту.
Нитрат натрия представляет собой эффективное азотное удобрение, которое применяется для подкормки всех растений. Также его можно использовать для подщелачивания грунта. Чтобы средство дало нужный эффект, важно придерживаться инструкции по его применению.