Нитрат магния
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Известен также метастабильный тетрагидрат. Гексагидрат — бесцветные кристаллы. Существует в трех модификациях. При —13-66 °C устойчива форма с моноклинной решеткой (а = 0,619 нм, b = 0,127 нм, с = 0,666 нм, b = 93°, пространств. группа P21/c); т. пл. 90 °C; плотность 1,46 г/см3; DH0пл 41,0 кДж/моль, DH0обр −2614,7 кДж/моль; S0298 427 Дж/(моль. К); уравнение температурной зависимости давления пара Н2О над твердым веществом: lgр(мм рт. ст.) = 10,0372 — 3088/Т (293—323 К); выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO. Дигидрат — бесцветные кристаллы с моноклинной решеткой (а = 0,581 нм, b = 0,599 нм, с = 0,865 нм, b = 90,7°, пространств. группа Р21/с); т. пл. 130 °C; плотн. 2,02 г/см3; DH0обр −1411,4 к Дж/моль; S0298 251 Дж/(моль. К).
Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg;
Компонент сложных удобрений, поскольку Магний входит в состав хлорофилла, который необходим для фотосинтеза, способствует повышению активности многих ферментов и выступает в роли транспортера фосфора. Высокая растворимость и низкая электропроводность делают продукт исключительно подходящим для листовой подкормки и фертигации, особенно при использовании оросительных вод с высокой концентрацией солей. Удобрение используется для корневого и некорневого питания овощных, ягодных, плодовых культур, винограда; окислитель в пиротехнических составах.
Нитрат магния
Из Википедии — свободной энциклопедии

наименование
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Известен также метастабильный тетрагидрат. Гексагидрат — бесцветные кристаллы. Существует в трёх модификациях. При —13-66 °C устойчива форма с моноклинной решёткой (а = 0,619 нм, b = 0,127 нм, с = 0,666 нм, b = 93°, пространств. группа P21/c); т. пл. 90 °C; плотность 1,46 г/см 3 ; DH0пл 41,0 кДж/моль, DH0обр −2614,7 кДж/моль; S0298 427 Дж/(моль. К); уравнение температурной зависимости давления пара Н 2 О над твёрдым веществом: lgр(мм рт. ст.) = 10,0372 — 3088/Т (293—323 К); выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO. Дигидрат — бесцветные кристаллы с моноклинной решёткой (а = 0,581 нм, b = 0,599 нм, с = 0,865 нм, b = 90,7°, пространств. группа Р21/с); т. пл. 130 °C; плотн. 2,02 г/см 3 ; DH0обр −1411,4 к Дж/моль; S0298 251 Дж/(моль⋅К).
Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также амины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов других металлов, а также разложении соединений Mg;
30-40% растворы нитрата магния технической чистоты, получаемые азотнокислотным разложением магнийсодержащего сырья (чаще, каустического магнезита или брусита) нашли применение в производстве концентрированной азотной кислоты (как обезвоживающий агент) и гранулированной аммиачной селитры (как модифицирующая добавка).
Компонент сложных удобрений, поскольку магний входит в состав хлорофилла, который необходим для фотосинтеза, способствует повышению активности многих ферментов и выступает в роли транспортера фосфора. Высокая растворимость и низкая электропроводность делают продукт исключительно подходящим для листовой подкормки и фертигации, особенно при использовании оросительных вод с высокой концентрацией солей. Удобрение используется для корневого и некорневого питания овощных, ягодных, плодовых культур, винограда; окислитель в пиротехнических составах.
Нитрат магния: способы получения и химические свойства
Нитрат магния Mg(NO3)2 — соль магния и азотной кислоты. Белый. При нагревании разлагается. Хорошо растворяется в воде (гидролиз по катиону).
Относительная молекулярная масса Mr = 148,31; относительная плотность для тв. и ж. состояния d = 1,636;
Способ получения
1. Нитрат магния можно путем взаимодействия магния и разбавленной азотной кислоты, образуется нитрат магния, оксид азота (I) и вода:
Качественная реакция
Качественная реакция на нитрат магния — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат магния образует сульфат магния, нитрат меди, бурый газ оксид азота и воду:
Химические свойства
1. Hитрат магния разлагается при температуре выше 300º С с образованием оксида магния, оксида азота (IV) и кислорода:
2. Возможны реакции между нитратом магния и сложными веществами :
2.1. Нитрат магния вступает в реакцию с основаниями :
2.1.1. В результате реакции между нитратом магния и разбавленным раствором гидроксида натрия образуется гидроксид магния и нитрат натрия:
Нитрат магния (Mg (NO3) 2): строение, свойства, применение
Содержание:
Mg (НЕТ3)2 это белое кристаллическое твердое вещество. Он очень гигроскопичен, то есть с легкостью впитывает воду из окружающей среды. Когда он остается в контакте с окружающим воздухом, он имеет тенденцию к образованию гексагидрата магния (NO3)2•6H2ИЛИ.
Гексагидрат нитрата магния Mg (NO3)2•6H2O имеет в своей кристаллической структуре 6 молекул воды H2Или для каждой молекулы Mg (NO3)2. Нитрат магния находится в пещерах и шахтах в виде минерала нитромагнезита.
Mg (НЕТ3)2 получают в промышленных масштабах реакцией металлического магния Mg с азотной кислотой HNO3.
Он имеет широкий спектр применения, например, в сельском хозяйстве в качестве удобрения, поскольку он обеспечивает питательные вещества для растений, такие как азот (N) и магний (Mg).
Его используют в производстве фейерверков или пиротехники, а также для получения концентрированной азотной кислоты. Он используется в химическом анализе, в физических экспериментах, а также в медицинских и научных исследованиях.
Состав
Ион NO3 – он имеет плоскую и симметричную структуру.
В составе NO3 – отрицательный заряд непрерывно распределяется между тремя атомами кислорода.
Номенклатура
-Безводный нитрат магния: Mg (NO3)2
Свойства
Физическое состояние
-Mg (НЕТ3)2 безводный: белое твердое вещество, кубические кристаллы.
-Mg (НЕТ3)2 дигидрат: белое кристаллическое твердое вещество.
-Mg (НЕТ3)2 гексагидрат: бесцветное твердое вещество, моноклинные кристаллы
Молекулярный вес
-Mg (НЕТ3)2 безводный: 148,31 г / моль
-Mg (НЕТ3)2 гексагидрат: 256,41 г / моль
Температура плавления
Точка кипения
-Mg (НЕТ3)2 гексагидрат: не кипит, разлагается при 330 ºC
Плотность
-Mg (НЕТ3)2 безводный: 2,32 г / см 3
-Mg (НЕТ3)2 дигидрат: 1,456 г / см 3
-Mg (НЕТ3)2 гексагидрат: 1,464 г / см 3
Растворимость
Безводный нитрат магния хорошо растворяется в воде: 62,1 г / 100 мл при 0 ºC; 69,5 г / 100 мл при 20 ° C. Также он очень гигроскопичен, при контакте с воздухом быстро образует гексагидрат.
Mg (НЕТ3)2 дигидрат также хорошо растворяется в воде и этаноле. Гигроскопичен.
Mg (НЕТ3)2 гексагидрат также хорошо растворяется в воде. Умеренно растворим в этаноле. Он наиболее устойчив из трех при контакте с воздухом, то есть из трех он наименее поглощает воду из окружающей среды.
Эффект нагрева
Воздействуя на водный раствор Mg (NO3)2 При испарении воды кристаллизуется соль, которая представляет собой гексагидрат: Mg (NO3)2•6H2О. Гексагидрат означает, что в твердом теле каждая молекула Mg (NO3)2 он прикреплен к 6 молекулам воды.
Существует также дигидрат Mg (NO3)2•2H2Или, в котором Mg (NO3)2 твердое вещество прикреплено к 2 молекулам воды.
Нагревание гексагидрата магния (НЕТ3)2•6H2Или безводная соль не получается, так как нитрат магния имеет высокое сродство к воде.
По этой причине при нагревании выше температуры плавления он сначала образует смешанную соль нитрата магния и гидроксида Mg (NO3)2•4 мг (OH)2.
Эта смешанная соль при достижении 400 ºC разлагается на оксид магния MgO и выделяются газы оксида азота.
Получение
Его можно получить путем реакции карбоната магния MgCO3 с азотной кислотой HNO3, выделяя углекислый газ CO2:
Его также можно получить с гидроксидом магния Mg (OH).2 и азотная кислота:
В промышленных масштабах его получают несколькими способами:
1- Взаимодействие металлического магния Mg с азотной кислотой HNO3.
2- Реакцией оксида магния MgO с азотной кислотой HNO3.
3- Связывание гидроксида магния Mg (OH)2 и нитрат аммония NH4Нет3, образуя нитрат магния с выделением аммиака NH3.
Расположение на природе
Mg (НЕТ3)2 гексагидрат естественным образом встречается в шахтах и пещерах в виде минерала нитромагнезита.
Приложения
Mg (НЕТ3)2 гексагидрат используется в керамической, химической и сельскохозяйственной промышленности.
Это соединение является удобрением, потому что оно обеспечивает азот (N), который является одним из трех основных элементов, необходимых для растений, и магний (Mg), который также является важным вторичным компонентом для растений.
Таким образом, он используется с другими ингредиентами в теплицах и при выращивании на гидропонике. Последний заключается в выращивании растений в водном растворе с солями удобрений вместо почвы.
Он также используется в качестве катализатора при получении нефтехимических соединений. Это позволяет регулировать вязкость в определенных процессах. Безводный нитрат магния используется в пиротехнике, то есть для изготовления фейерверков.
Безводный нитрат магния является дегидратирующим агентом. Его используют, например, для получения концентрированной азотной кислоты, так как он удаляет воду и концентрирует кислотные пары до 90-95% HNO.3.
Он также используется для покрытия нитрата аммония и позволяет обрабатывать такой прессованный материал жемчугом.
Он используется при приготовлении чернил, тонера (черный порошок, используемый в копировальных системах) и красителей. Он служит эталоном магния в аналитической химии.
Соль нитрата магния и церия Mg (NO3)2•Хмуриться3)3 Он представляет интерес для физических экспериментов при низких температурах, так как используется в качестве хладагента в экспериментах по адиабатическому размагничиванию (без теплообмена).
Эта соль магния и церия использовалась для установления чрезвычайно низких уровней температуры по шкале Кельвина (близких к абсолютному нулю).
В последних исследованиях
Несколько исследователей использовали Mg (NO3)2 в композициях с синтетическими и натуральными полимерами для увеличения проводимости в ионно-магниевых батареях.
Он также был исследован при создании суперконденсаторов для хранения энергии большой мощности.
В исследованиях болезней
Нитрат магния вводили лабораторным крысам с артериальной гипертензией (высоким давлением), и было обнаружено, что он эффективно снижает артериальное давление и ослабляет или смягчает последствия осложнений этого заболевания.
Он также показал защитные эффекты против неврологических расстройств (нейрональное расстройство) и против гибели крыс во время процессов закупорки сонных артерий.
Ссылки
Что такое делитель напряжения? (с примерами)
Природная и социальная среда в удовлетворении потребностей человека
Нитрат магния ГОСТ 11088-75
| Нитрат магния | |
|---|---|
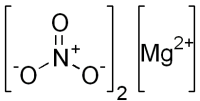 | |
| Систематическое наименование | Нитрат магния |
| Хим. формула | Mg(NO3)2 |
| Рег. номер CAS | 10377-60-3 |
| PubChem | 25212 |
| Рег. номер EINECS | 233-826-7 |
| SMILES | |
| ChEBI | 64736 |
| ChemSpider | 23415 |
| ГОСТ | ГОСТ 11088-75 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Известен также метастабильный тетрагидрат. Гексагидрат — бесцветные кристаллы. Существует в трех модификациях. При —13-66 °C устойчива форма с моноклинной решеткой (а = 0,619 нм, b = 0,127 нм, с = 0,666 нм, b = 93°, пространств. группа P21/c); т. пл. 90 °C; плотность 1,46 г/см3; DH0пл 41,0 кДж/моль, DH0обр −2614,7 кДж/моль; S0298 427 Дж/(моль. К); уравнение температурной зависимости давления пара Н2О над твердым веществом: lgр(мм рт. ст.) = 10,0372 — 3088/Т (293—323 К); выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO. Дигидрат — бесцветные кристаллы с моноклинной решеткой (а = 0,581 нм, b = 0,599 нм, с = 0,865 нм, b = 90,7°, пространств. группа Р21/с); т. пл. 130 °C; плотн. 2,02 г/см3; DH0обр −1411,4 к Дж/моль; S0298 251 Дж/(моль. К).
Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg;
30-40% растворы нитрата магния технической чистоты, получаемые азотнокислотным разложением магнийсодержащего сырья (чаще, каустического магнезита или брусита) нашли применение в производстве концентрированной азотной кислоты (как обезвоживающий агент) и гранулированной аммиачной селитры (как модифицирующая добавка).
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется нитрат магния, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Как пишется нитрат магния", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.




