Как пишется хром в таблице менделеева
Хром / Chromium (Cr), 24
Хром — элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium ). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
Содержание
История
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Нахождение в природе
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mn, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы и их неточно называют «хромиты». Состав их изменчив:
Собственно хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
Физические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром имеет твердость по шкале Мооса 5. [4] Очень чистый хром достаточно хорошо поддаётся механической обработке.
Химические свойства
Характерные степени окисления
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr 2+ (растворы голубого цвета) получаются при восстановлении солей Cr 3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6] 3+ до зелёного (в координационной сфере присутствуют анионы).
Cr 3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:

Сплавляя Cr2O3 со щелочами получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (рассплав при этом приобретает жёлтую окраску):
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:

Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Интересные факты
См. также
Примечания
Ссылки
 Монетные металлы Монетные металлы | |
|---|---|
| Металлы | Алюминий (Al) | Железо (Fe) | Золото (Au) | Медь (Cu) | Никель (Ni) | Олово (Sn) | Палладий (Pd) | Платина (Pt) | Серебро (Ag) | Свинец (Pb) | Хром (Cr) | Цинк (Zn) |
| Сплавы | Акмонитал | Алюминиевая бронза (CuAl) | Биллон (CuAg) | Бронза (CuSn) | Колыванская медь (CuAuAg) | Латунь (CuZn) | Медно-никелевый сплав (CuNi) | Мельхиор (CuNiFeMn) | Нейзильбер, нойзильбер (CuZnNi) | Нержавеющая сталь (FeCrNi) | Никелевая бронза (CuSnNi) | Никелево-железный сплав (NiFe) | Никелево-цинковый сплав (NiZn) | Потин | Северное золото (CuAlZnSn) | Сталь (Fe) | Стерлинг (AgCu) | Томпак (CuZn) | Хромированная сталь (FeCr) | Чугун (Fe) | Электр, электрон, электрум (AuAg) |
| Группы монет | Биметаллические монеты | Бронзовые монеты | Медные монеты | Железные монеты | Золотые монеты | Палладиевые монеты | Платиновые монеты | Серебряные монеты | Сибирская монета |
| Группы металлов | Монетная группа (подгруппа меди) | Благородные металлы | Платиновая группа |
| См. также | Безмонетный период | Бумажные деньги | Денежная бумага | Кожаные рубли | Марки-деньги | Монетное дело | Нотгельд | Символы благородных металлов |
Полезное
Смотреть что такое «Хром» в других словарях:
хром — хром, а … Русский орфографический словарь
хром — хром/ … Морфемно-орфографический словарь
хром — а; м. [от греч. chrōma цвет, краска] 1. Химический элемент (Сr), твёрдый металл серо стального цвета (используется при изготовлении твёрдых сплавов и для покрытия металлических изделий). 2. Мягкая тонкая кожа, выдубленная солями этого металла.… … Энциклопедический словарь
ХРОМ — (от греч. chroma цвет, краска). Металл сероватого цвета, добываемый из хромовой руды. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ХРОМ металл сероватого цвета; в чистом виде х. не употребляется; соединения же с … Словарь иностранных слов русского языка
ХРОМ — см. ХРОМ (Сг). Соединения хрома встречаются в сточных водах многих промышленных предприятий, производящих хромовые соли, ацетилен, дубильные вещества, анилин, линолеум, бумагу, краски, пестициды, пластмассы и др. В воде встречаются трехвалентные… … Болезни рыб: Справочник
хром — ХРОМ, а, муж. 1. Химический элемент, твёрдый светло серый блестящий металл. 2. Род жёлтой краски (спец.). | прил. хромистый, ая, ое (к 1 знач.) и хромовый, ая, ое. Хромистая сталь. Хромовая руда. II. ХРОМ, а, муж. Сорт мягкой тонкой кожи. | прил … Толковый словарь Ожегова
хром — а, м. chrome m. [krom] <новолат. chromium <лат. chroma <гр. краска. 1. Химический элемент твердый серебристый металл, употребляемый при изготовлении твердых сплаво и для покрытия металлических изделий. БАС 1. Металл, открытый Вокеленом,… … Исторический словарь галлицизмов русского языка
ХРОМ — (лат. Chromium) Cr, химический элемент VI группы Периодической системы Менделеева, атомный номер 24, атомная масса 51,9961. Название от греч. chroma цвет, краска (из за яркой окраски Соединения). Голубовато серебристый металл; плотность 7,19… … Большой Энциклопедический словарь
ХРОМ 1 — ХРОМ 1, а, м. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ХРОМ 2 — ХРОМ 2, а, м. Сорт мягкой тонкой кожи. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Хром (Cr, Chromium)
История хрома
Первое упоминание о хроме, как о самостоятельном элементе встречается в трудах М.В. Ломоносова 1763 года, после того, как металл открыли Березовском месторождении золотой руды. Автор называл его красной свинцовой рудой. Соединения хрома имеют разнообразные окраски, видимо, поэтому элементы присвоили название хром – от греческого χρῶμα – краска, цвет.
Общая характеристика хрома
Хром является элементом побочной подгруппы VI группы IV периода в периодической системе химических элементов Д.И. Менделеева, имеет атомный номер 24 и атомную массу 51,966. Принятое обозначение – Cr (от латинского Chromium).
Нахождение в природе
Хром распространён в земной коре, самые известные соединения – хромит и крокоит. Месторождения хрома находятся в ЮАР, Турции, Зимбабве, Армении, Индии и на Среднем Урале в России.
Физические и химические свойства
Хром является твёрдым металлом (часто его называют чёрным металлом), имеет бело-голубой цвет и одну из самых высоких твёрдостей.
Суточная потребность в хроме
Необходимая суточная дозировка в хроме для детей составляет от 11 до 35 мкг в зависимости от возраста, для женщин необходимо получать 50-70 мкг хрома в сутки, во время беременности потребность вырастает до 100-120 мкг. Взрослые здоровые мужчины должны получать 60-80 мкг хрома в день, при активных занятиях спортом или иных физических нагрузках суточная дозировка составляет 120-200 мкг.
Продукты питания богатые хромом
Основные поставщики хрома в организм человека – говяжья печень и пивные дрожжи, далее следуют картофель в мундире, помидоры, брокколи, редис и зелёный лук, говядина и куриное мясо, хлеб из муки грубого помола, зёрна пшеницы, чёрный перец, есть хром в кукурузном масле и морепродуктах, сыре, тунце, скумбрии и сельди, фруктах и ягодах, бобовых продуктах и некоторых крупах – перловке и манке.
Признаки нехватки хрома
Признаками недостатка хрома в организме человека являются:
Признаки избытка хрома
Избыточное содержание хрома в организме характеризуется аллергическими реакциями и воспалительными процессами, возникают язвочки на слизистых, нервные расстройства и нарушения в деятельности печени и почек.
Полезные свойства хрома и его влияние на организм
Хром играет важную роль в жизнедеятельности человека, принимает участие в липидном и углеродном обменах, способствует выведению «плохого» холестерина и отвечает за переработку жировых отложений, тем самым поддерживая вес в норме. Способность хрома замещать йод играет важнейшую роль для щитовидной железы, также хром незаменим для профилактики остеопороза, укрепляя костную ткань. Хром стимулирует процессы регенерации тканей – сохраняет в генах наследственную информацию.
Применение хрома в жизни
Основное применение хром нашёл в металлургической промышленности, где его используют для повышения твёрдости и коррозийной стойкости сплавов, в процессе хромирования, также применяется в авиакосмической отрасли промышленности.
Хром Cr
Хром в таблице менделеева занимает 24 место, в 4 периоде.
| Символ | Cr |
| Номер | 24 |
| Атомный вес | 51.9961000 |
| Латинское название | Chromium |
| Русское название | Хром |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
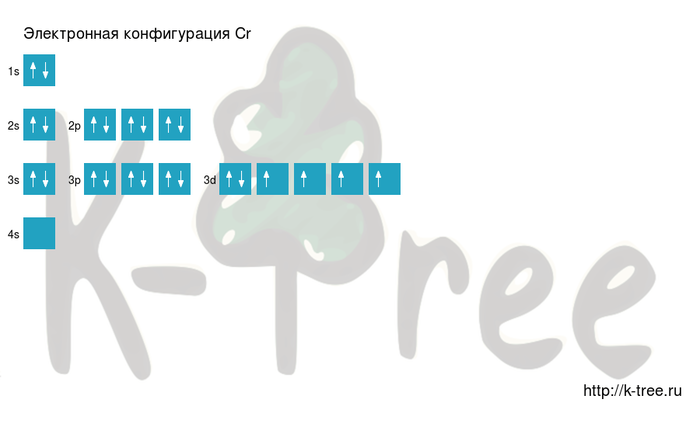
Электронная схема хрома
Cr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Короткая запись:
Cr: [Ar]4s 1 3d 5
Порядок заполнения оболочек атома хрома (Cr) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Хром имеет 24 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
5 электронов на 3d-подуровне
Степень окисления хрома
Ионы хрома
Валентность Cr
Атомы хрома в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хрома характеризует способность атома Cr к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cr
Квантовые числа определяются последним электроном в конфигурации, для атома Cr эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Хром – полезные свойства и особенности металла
Этот металл любят все. Промышленники – за отличные полезные характеристики. Эстеты и любители шикарных авто – за красоту и практичность. Хром востребован военными и ядерщиками.
Что представляет собой
Хром – это металл, элемент таблицы Менделеева №24.
Международное обозначение и формула – Chromium, Cr.
Серебристо-голубоватое блестящее вещество – одно из самых твердых (5,5 по Моосу) и тугоплавких металлов, но хрупко. Относится к чёрным металлам.
Структура, свойства роднят его с железом, марганцем, титаном, никелем. Эти элементы объединены в одно семейство.
Уникальная особенность элемента – ярко-радужная окраска соединений: голубизна, фиолет, зелень до изумрудности, желтизна, оранж, пурпур. Они обусловили название, благодаря им легко отличить хром от других металлов.
По-древнегречески χρῶμα (хрома) – краска, цвет.
История открытия
Хром как самостоятельный элемент впервые в истории упомянут Михаилом Ломоносовым (1763 год). Великий русский ученый обнаружил его, исследуя золотую руду с Урала (Березовский рудник).
Это был минерал крокоит. Первооткрыватель нарек его красной свинцовой рудой.
Спустя тридцать лет его французский коллега Луи Николя Воклен выделил из «сибирского красного свинца» металл с примесью карбида.
Месторождения и добыча
Первое и второе место по запасам у ЮАР и Казахстана.
Россия третья. Ее месторождения – на Среднем Урале.
Хромовые руды есть также у Зимбабве, Турции, Армении, Индии, на Филиппинах, Мадагаскаре.
Добыча ведется традиционными способами – карьерным либо шахтным.
Физико-химические характеристики
Физические и химические свойства хрома типичны для металлов:
Применение хрома затрудняют недостатки:
Однако они компенсируются достоинствами металла: тугоплавкостью, твердостью (пятый среди металлов), стойкостью к коррозии.
| Свойства атома | |
|---|---|
| Название, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) | 51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K (1856,9 °C) |
| Температура кипения | 2945 K (2671,9 °C) |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Нахождение в природе
В природе отмечено два десятка хромовых минералов. Основные – хромит и крокоит.
Изверженные породы содержат разную концентрацию элемента (г/т):
Каждая тонна земной коры содержит в среднем 83 г хрома.
Промышленный интерес представляет один класс – хромшпинелиды.
Металл содержат драгоценные камни – хромтурмалин, уваровит (хромовый гранат), другие.
Технология получения
Традиционное сырье для получения хрома – хромшпинелиды.
Главные способы получения металла – обогащение руды методом электролиза либо восстановлением.
Для повышения степени чистоты конечного продукта сырье сплавляют в электропечи с содой, добавляя кислород.
Производство металлического хрома почти абсолютной чистоты ведется методом электролиза концентрированных хромовых растворов либо восстановлением оксида хрома алюминием в вакуумных печах (при 1500°C).
Где используется
Металл используется по двум направлениям: как лигатура к другим металлам и как покрытие.
Металлургия
Отрасль, забирающая три четверти объемов металла. Хромом легируют стали для улучшения кондиций.
Такие достоинства сталей обусловили их применение как материала стволов артиллерии, корпусов субмарин, сейфов, металлорежущего, медицинского, химического инструментария. Из них выполнены двигатели космических кораблей, начинка плазмотронов.
Даже незначительное количество хрома в составе кратно улучшает механические свойства материала.
Самые известные хромсодержащие сплавы – с никелем (нихром) и железом (фехраль). Это прецизионные материалы с повышенным электрическим сопротивлением. Используются для работы при экстремальных температурах.
Другие отрасли промышленности
Продукция из металла и сплавов с ним выпускается для разных сегментов рынка:
Краски из перетертых хромовых руд применяли еще иконописцы Древней Руси.
Хром закупают фармацевтические гиганты, производители биодобавок, препаратов для похудения.
Декор
Хромированное покрытие корпуса часов либо деталей авто – не только маркер статусности. Такая обработка защищает от износа, коррозии, механических повреждений.
Толщина покрытия металлом зависит от назначения изделия: от 2 мкм (декоративный ассортимент) до 0,1 мм (детали байков, велосипедов, авто).
Процесс покрытия хромом называется хромированием. Он технологически прост и недорог.
На мировых биржах реализуют хромовую руду (Cr – 42%) в основном из Китая.
Значение для человека
Хром присутствует в организме человека изначально.
Здоровье
Он – участник ряда биологических процессов:
Достаточное содержание хрома в организме критично важно для людей с лишним весом, диабетом, заболеваниями щитовидной железы, сердца, сосудов.
Питание
Хромом богаты продукты всех основных групп:
Металлом насыщены сыры, бобовые, кукурузное масло, фрукты, хлеб из муки крупного помола, пивные дрожжи.
Дозировка
Ежесуточная потребность в хроме (мкг):
При беременности у женщин, активном образе жизни, физических нагрузках у мужчин потребность удваивается.
Предостережение
Опасность представляет чистый металл. Особенно попадание его пыли в дыхательную систему.
Это провоцирует онкологию, раздражение кожи.
По стандартам РФ, предельно допустимая концентрация хрома – 1,5 мкг на кубометр.
Люди, работающие на металлургических предприятиях, пользуются респираторами, другими средствами защиты.
Хромовая «пудра» самовоспламеняется на воздухе.