Практическое занятие № 8. Получение этилена и изучение его свойств
Задания. 1. Получите этилен из этилового спирта.
2. Проведите характерные реакции для этилена как представителя непредельных углеводородов.
Оборудование. Прибор для получения этилена, штатив с пробирками, стеклянные трубки с оттянутым концом, лучинка, фарфоровая пластинка или чашечка, чашка с песком, лабораторный штатив, горелка, спички, мензурка, свернутая спирально медная проволока, которая должна быть вложена в газоотводную трубку.
Вещества. Этиловый спирт, серная кислота (конц.), раствор бромной воды и розовый раствор подкисленного перманганата калия, промытый и прокаленный речной песок.
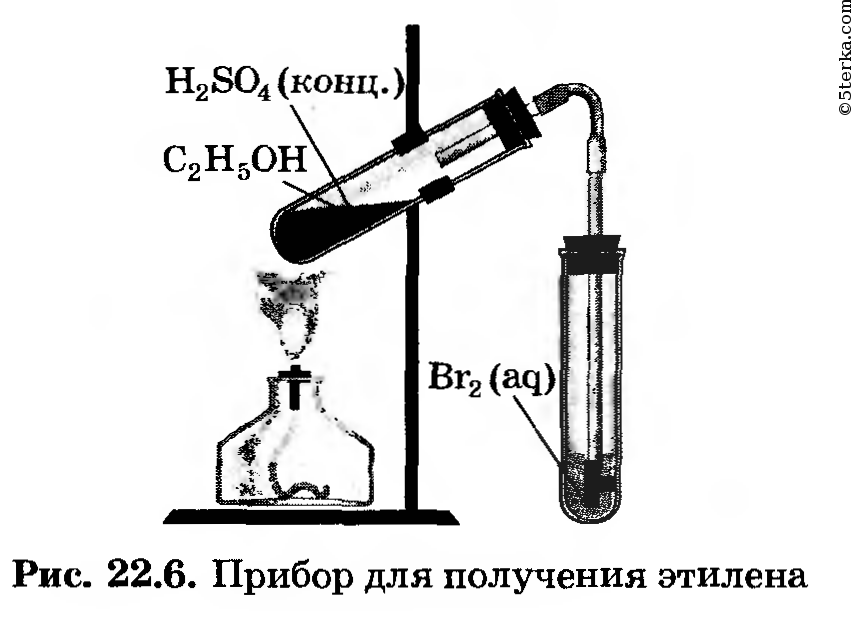
1. Получение этилена. Соберите прибор для получения этилена (рис. 22.6) и проверьте его на герметичность.
Для получения этилена в пробирку поместите 1,5 мл этилового спирта, затем осторожно прилейте 4 мл концентрированной серной кислоты и добавьте в смесь немного прокаленного песка. Закройте пробирку пробкой с газоотводной трубкой и закрепите прибор в штативе.
2. В две пробирки прилейте по 2 мл растворов бромной воды и перманганата калия. Нагрейте в приборе для получения этилена смесь до кипения и, не переставая нагревать, но не перегревая, опустите конец газоотводной трубки сначала в
пробирку с бромной водой, а затем в пробирку с раствором перманганата калия.
Что вы наблюдаете? Составьте уравнения химических реакций: а) получения этилена из этилового спирта; б) взаимодействия этилена с бромной водой.
Направьте конец газоотводной трубки прибора вверх и подожгите лучиной выделяющийся этилен. Отметьте характер пламени. Внесите в пламя этилена на несколько секунд фарфоровую пластинку или чашу. Что вы наблюдаете?
Вдувайте воздух через стеклянную трубку с оттянутым концом в среднюю часть пламени этилена. Как изменяется яркость пламени? Почему? Составьте уравнение реакции горения этилена.
Концентрированная серная кислота обладает свойством отбирать воду у других веществ. Это свойство использовано для получения этилена.
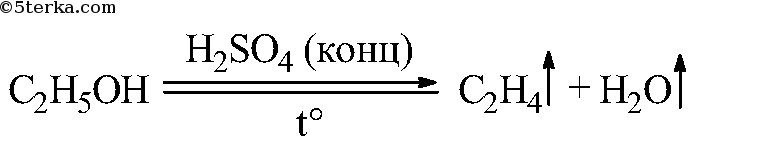
Вода частично конденсируется на стенках пробирки и скатывается обратно в раствор. Этилен уходит по газообразной трубке. Свойства этилена:
При пробулькивании этилена через раствор бромной воды и перманганата происходит обесцвечивание.
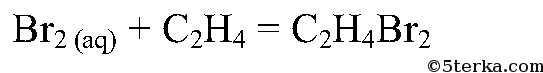
Этилен горит желтым пламенем, при внесении фарфоровой чашки она чернеет, из-за неполного сгорания этилена образуется свободный углерод — сажа черного цвета. При вдувании воздуха в пламя этилена происходит полное сгорание этилена, и пламя из желтого становится синим.
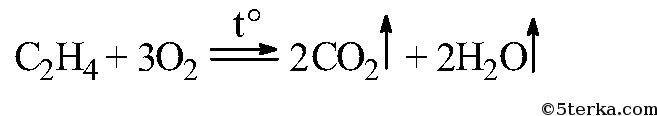
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
Этилен в лабораторных условиях получается в результате следующих химических реакций:
Применение и использование этилена (этена):
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Тема: «Получение этилена и изучение его свойств»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
ГОСУДАРСТВЕННОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ДОНЕЦКИЙ ТЕХНИКУМ ХИМИЧЕСКИХ ТЕХНОЛОГИЙ И ФАРМАЦИИ»
Методическая разработка лабораторного занятия
Тема: «Получение этилена
и изучение его свойств »
Дисциплина ОП.09. Органическая химия
Разработчик: Голоперова И.И., преподаватель, специалист высшей квалификационной категории ГПОУ «Донецкий техникум химических технологий и фармации»
ЛАБОРАТОРНАЯ РАБОТА № 2
Тема: Получение этилена и изучение его свойств.
Цель: получить этилен и установить с помощью качественных реакций наличие двойной связи в его молекуле.
Реактивы и оборудование: этиловый спирт (96%-ный), серная кислота (ρ=1,84 г/см 3 ), бромная вода (насыщенный раствор), 0,1 н раствор перманганата калия, песок, газоотводная трубка, горелка, штатив с пробирками.
2. Габриелян О.С., Остроумова И.Г. Химия: учебник для студентов СПО. – 9-е изд.,стер.-М.:ИЦ.Академия, 2011.
1.Габриелян О.С.,Лысова, Г.Г. Химия: учебник.11 класс.-М.:Дрофа, 2011.-398 с.: ил.
2.Ерохин,Ю.М. Химия.- М.: Издательство центр Академия, 2009.-318 с.: ил.
Презентация на тему «Алкены»:
Видео-опыты посмотреть по ссылке:
С облюдать правила техники безопасности при работе с нагревательными приборами, кислотами.
Работу проводить в вытяжном шкафу. Концентрированную серную кислоту приливать к этиловому спирту тонкой струей при перемешивании. Приливать спирт в кислоту запрещается. Разлитую кислоту нейтрализуют, после чего проводят уборку.
Алкены, или ненасыщенные углеводороды этиленового ряда (иногда их называют олефинами), содержащие в составе своей молекулы одну двойную связь. Двойная связь – это сочетание ковалентных σ-связей и π-связей. Самый первый представитель алкенов – этилен СН 2 =СН 2 . Атомы углерода, соединенные между собой двойной связью, находятся в состоянии sp 2 -гибридизации. Гибридизованные орбитали расположены в одной плоскости и направлены друг к другу под углом 120º, образуя равносторонний треугольник. Ненасыщенные углеводороды имеют общую формулу С n Н 2n . Они способны вступать в реакции присоединения водорода, галогенов, галогенводородов (по правилу Марковникова). Эти соединения легко окисляются. При наличии катализаторов вступают в реакции полимеризации и изомеризации. Горят.
1) получить этилен; 2) установить, реагирует ли этилен с бромом и перманганатом калия в условиях опыта; 3) написать уравнения всех реакций; 4) сделать вывод о реакционной способности этилена в сравнении с метаном.
Опыт 1. Получение этилена
Этилен и его гомологи в лабораторных условиях чаще всего получают дегидратацией соответствующих спиртов. В частности, этилен получают из этилового спирта действием на него концентрированной серной кислоты при нагревании (реакцию можно ускорить добавлением в смесь оксида алюминия Аl 2 О 3 ).
В сухую пробирку вносят 1 г сухого промытого речного песка, 3 мл этилового спирта и 9 мл концентрированной серной кислоты (ρ = 1,84 г/см 3 ). Пробирку закрывают пробкой с газоотводной трубкой и закрепляют в штативе. Песок добавляют к смеси для равномерного кипения и для предотвращения выбросов веществ из пробирки. Конец газоотводной трубки погружают в пробирку с водой. Смесь нагревают.
Опыт 2. Присоединение брома к этилену
Этилен легко вступает в реакции присоединения.
Полученный в опыте 1 этилен через газоотводную трубку пропускают в пробирку, в которую предварительно налито 1-2 мл раствора бромной воды.
Опыт 3. Окисление этилена раствором перманганата калия
Реакция разработана Е.Е.Вагнером (1888). С ее помощью в молекулах органических веществ обнаруживают двойную связь.
Полученный в опыте 1 этилен через газоотводную трубку пропускают в пробирку, в которую предварительно налито 1-2 мл раствора перманганата калия и 5-10 мл воды.
Опыт 4. Горение этилена
Этиленовые углеводороды горят.
Смесь продолжают нагревать в пламени горелки. К отверстию газоотводной трубки подносят зажженную спичку или лучину, полученный газ поджигаем.
Оформите работу в тетради в виде таблицы:
Уравнение реакции, выводы
Какой газ выделяется?
Закончите уравнение реакции:
Укажите тип реакции, назовите продукты реакции?
Что происходит с раствором марганцовки?
Закончите уравнение реакции:
Назовите продукты и тип реакции?
Почему происходит обесцвечивание бромной воды?
Почему этилен горит более светящимся пламенем, чем этан?
Закончите уравнение реакции:
Назовите тип реакции и продукты?
Вопросы для самоконтроля:
1. Дайте определение понятию «бромная вода».
2. Какими качественными реакциями можно доказать наличие кратных углерод-углеродных связей в ряду непредельных углеводородов?
3. Что такое «кипелки» и для чего они нужны в данных условиях протекания опыта?
4. Перечислите основные способы получения этилена в промышленности.
5. Объясните, почему при горении этилена образуется налёт сажи.
6. Какие типы реакций наиболее характерны для этилена и почему?
7. Сравните реакционную способность метана и этилена. Чем обусловлены такие различия?
Задания для защиты лабораторной работы:
1. Какие виды изомерии характерны для алкенов? Напишите формулы возможных изомеров пентена-1.
2. Из каких соединений может быть получен: а) изобутен (2-метилпропен); б) бутен-2; в) бутен-1? Напишите уравнения соответствующих реакций.
3. Перечислите области применения этилена и пропилена.
4. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б, В:
5. На полное гидрирование 2,8 г алкена израсходовано 0,896 л водорода (н. у.). Какова молекулярная масса и структурная формула этого соединения, имеющего нормальную цепь углеродных атомов? Ответ: 70.













