Марганец (Mn, Manganum)
История марганца
Первооткрывателями марганца принято считать шведских химиков К. Шееле и Ю. Гана, первый из которых в 1774 году обнаружил неизвестный металл в широко используемой железной руде, называемой в древности чёрной магнезией, второй же путём нагревания смеси пиролюзита (основного минерала марганца) с углём получил металлический марганец ( calorizator). Название новый металл получил от немецкого Manganerz, т.е. марганцевая руда.
Общая характеристика марганца
Марганец является элементом побочной подгруппы VII группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 25 и атомную массу 54,9380. Принятое обозначение – Mn (от латинского Manganum).
Нахождение в природе
Марганец достаточно распространён, входит во вторую десятку элементов по распространённости. В земной коре встречается чаще всего совместно с железными рудами, но имеются и месторождения именно марганца, например в Грузии и России.
Физические и химические свойства
Марганец является тяжёлым серебристо-белым металлом, так называемым чёрным металлом. При нагревании имеет свойство разлагать воду, вытесняя водород. В обычном состоянии поглощает водород.
Суточная потребность в марганце
Для взрослого здорового человека суточная потребность в марганце составляет 5-10 мг.
Продукты питания богатые марганцем
Марганец попадает в организм человека с пищей, поэтому в обязательном порядке необходимо ежедневно съедать один или несколько продуктов из следующего списка:
Полезные свойства марганца и его влияние на организм
Функции марганца в организме человека:
Взаимодействие с другими
Марганец помогает активизировать ферменты, необходимые для правильного использования организмом биотина, витаминов B1 и С. Взаимодействие марганца с медью и цинком является признанным антиоксидантным средством. Большие дозы кальция и фосфора будут задерживать всасывание марганца.
Применение марганца в жизни
Наибольшее применение марганец нашёл в металлургии, также при производстве реостатов, гальванических элементов. Соединения марганца используют как термоэлектрический материал.
Признаки нехватки марганца
При режиме питания, утяжелённом большим количеством углеводов, в организме происходит перерасход марганца, что проявляется следующими симптомами: анемия, снижение прочности костей, задержка роста, а также атрофия яичников у женщин и яичек у мужчин.
Признаки избытка марганца
Излишек марганца также неполезен организму, его проявлениями могут служить сонливость, боли в мышцах, потеря аппетита и изменения в формировании костей – так называемый «марганцевый» рахит.
Марганец Mn
Марганец в таблице менделеева занимает 25 место, в 4 периоде.
| Символ | Mn |
| Номер | 25 |
| Атомный вес | 54.9380440 |
| Латинское название | Manganum,Manganesium |
| Русское название | Марганец |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
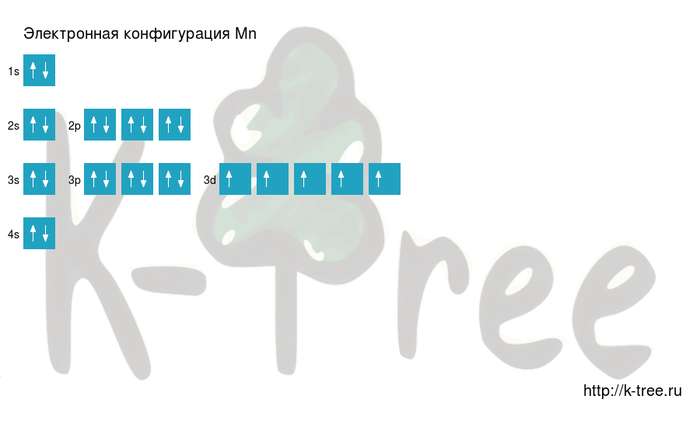
Электронная схема марганца
Mn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5
Короткая запись:
Mn: [Ar]4s 2 3d 5
Порядок заполнения оболочек атома марганца (Mn) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Марганец имеет 25 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
5 электронов на 3d-подуровне
Степень окисления марганца
Ионы марганца
Валентность Mn
Атомы марганца в соединениях проявляют валентность VII, VI, V, IV, III, II, I.
Валентность марганца характеризует способность атома Mn к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mn
Квантовые числа определяются последним электроном в конфигурации, для атома Mn эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Марганец, свойства атома, химические и физические свойства
Марганец, свойства атома, химические и физические свойства.
54,938045(5) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
Марганец — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Расположен в 7-й группе (по старой классификации — побочной подгруппе седьмой группы), четвертом периоде периодической системы.
Физические свойства марганца
Атом и молекула марганца. Формула марганца. Строение атома марганца:
Марганец – металл. Относится к группе переходных металлов. Относится к чёрным металлам.
Марганец обозначается символом Mn.
Как простое вещество марганец при нормальных условиях представляет собой твёрдый, тяжёлый, хрупкий металл серебристо-белого цвета.
Молекула марганца одноатомна.
Химическая формула марганца Mn.
Строение атома марганца. Атом марганца состоит из положительно заряженного ядра (+25), вокруг которого по четырем оболочкам движутся 25 электронов. При этом 23 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку марганец расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома марганца на 3d-орбитали находится пять неспаренных электронов. На внешнем энергетическом уровне атома марганца – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома марганца состоит из 25 протонов и 30 нейтронов.
Радиус атома марганца (вычисленный) составляет 161 пм.
Атомная масса атома марганца составляет 54,938045(5) а. е. м.
Изотопы и модификации марганца:
Свойства марганца (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Марганец |
| 102 | Прежнее название | |
| 103 | Латинское название | Manganum |
| 104 | Английское название | Manganese |
| 105 | Символ | Mn |
| 106 | Атомный номер (номер в таблице) | 25 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, чёрный металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1774 г., Юхан Готлиб Ган (получен в чистом виде), Швеция, 1774 г. |
| 110 | Год открытия | 1774 г. |
| 111 | Внешний вид и пр. | Твёрдый, тяжёлый, хрупкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 4 аллотропные модификации марганца: – α-марганец с искажённой кубической объёмно-центрированной кристаллической решёткой, – β-марганец с искажённой кубической объёмно-центрированной кристаллической решёткой, – γ-марганец с кубической гранецентрированной кристаллической решёткой, |
| 204 | Радиус атома (вычисленный) | 161 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 139 пм – low-spin, 161 пм – high-spin |
| 207 | Радиус иона (кристаллический) | Mn 2+ low spin 5,95 г/см 3 (при температуре плавления 1246 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 1246 °C (1519 K, 2275 °F) |
| 403 | Температура кипения* | 2061 °C (2334 K, 3742 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 12,91 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 221 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,479 Дж/г·K (при 25 °C) – α-марганец |
| 410 | Молярная теплоёмкость* | 26,32 Дж/(K·моль) |
| 411 | Молярный объём | 7,35449 см³/моль |
| 412 | Теплопроводность | 7,81 Вт/(м·К) (при стандартных условиях ), 6,87 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-марганец |
| 512 | Структура решётки | Искажённая кубическая объёмно-центрированная |
| 513 | Параметры решётки | 8,890 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 400 K |
| 516 | Название пространственной группы симметрии | I_ 43m |
| 517 | Номер пространственной группы симметрии | 217 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-96-5 |
205* Эмпирический радиус атома марганца согласно [1] и [3] составляет 127 пм.
206* Ковалентный радиус марганца согласно [1] составляет 139±5 пм (low-spin) и 161±8 пм (high-spin), согласно [3] составляет 117 пм.
402* Температура плавления марганца согласно [3] и [4] составляет 1243,85 °C (1517 K, 2270,93 °F) и 1245 °C (1518,15 K, 2273 °F) соответственно.
403* Температура кипения марганца [3] и [4] составляет 1961,85 °C (2235 K, 3563,33 °F) и 2080 °C (2353,15 K, 3776 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) марганца согласно [3] и [4] составляет 13,4 кДж/моль и 12 кДж/моль (α-марганец) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) α-марганца согласно [4] составляет 227 кДж/моль.
410* Молярная теплоемкость марганца согласно [3] составляет 26,3 Дж/(K·моль).
Марганец
| Марганец / Manganum (Mn) | |
|---|---|
| Атомный номер | 25 |
| Внешний вид простого вещества | Файл:Mangan 1.jpg |
твёрдый, хрупкий металл светло-серого цвета
( молярная масса )
(первый электрон)
(по Полингу)
Содержание
Распространённость в природе
Схема атома марганца
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожненское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
см. Марганцевые руды
Минералы марганца
Биологическая роль и содержание в живых организмах
Получение
1. Из гаусманита или прокалённого пиролюзита (переходит в гаусманит) алюминотермическим методом:
3. Чистый металлический марганец получают электролизом
Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
Химические свойства
Характерные степени окисления марганца: +2, +3, +4, +6, +7 (+1, +5 мало характерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде (Mn + O2 → MnO2). Марганец при нагревании разлагает воду, вытесняя водород (Mn + 2H2O →(t) Mn(OH)2 + H2↑), образующийся гидроксид марганца замедляет реакцию.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой рекция идёт по уравнению:
С разбавленой азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях жидкое вещество, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении окисда марганца (IV) ( пиролюзит ) со щелочами в присутствии кислорода образуются манганаты :
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4 − и из него выпадает коричневый осадок гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли ( перманганаты ) — сильные окислители. Например, перманаганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :
Эта реакция используется для качественного определения Mn 2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окислления. Подробное описание реакции см. в разделе «Определение методами химического анализа».
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
Применение в промышленности
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь(так называемая Сталь Гадфильда ), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твердой и сопротивляющейся износу и ударам(эта сталь резко упрочняется и становится тверже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Цены на металлический марганец в слитках чистотой 95 % в 2006 году составили в среднем 2,5 долл/кг.
Арсенид марганца обладает гигантским магнитокалорическим эффектом (усиливающимся под давлением). Теллурид марганца перспективный термоэлектрический материал(термо-э.д.с 500 мкВ/К).
Определение методами химического анализа
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn 2+ следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn 2+ до MnO 4- с образованием марганцевой кислоты малинового цвета:
Эта реакция дает отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца эта реакция не удаётся, так как избыток ионов Mn 2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2 и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn 2+ в MnO4 − могут быть использованы другие окислители, например персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag + или висмутата натрия NaBiO3:
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца (II) MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца (II), окрашенный в телесный цвет:
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония.