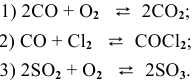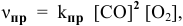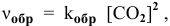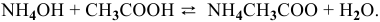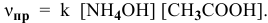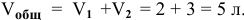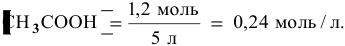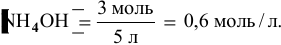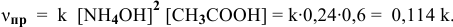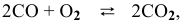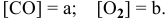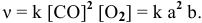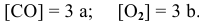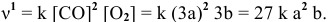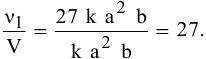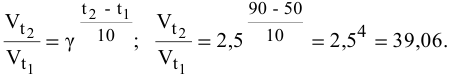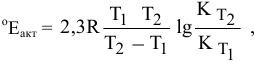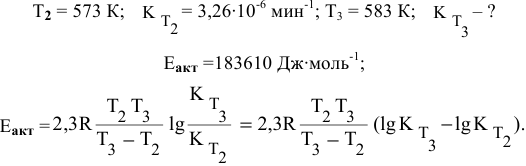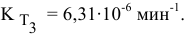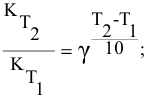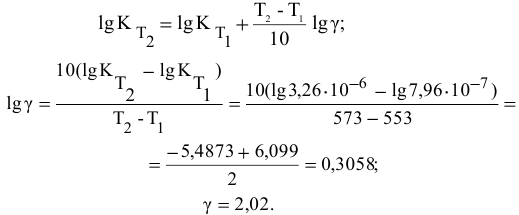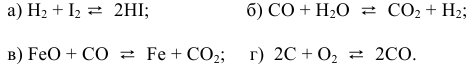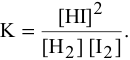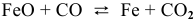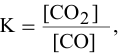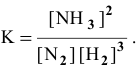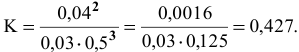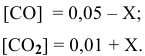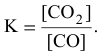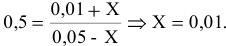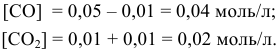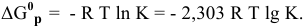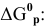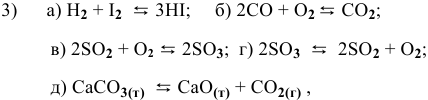Примеры решения задач
Пример 14. Составить математическое выражение для скоростей следующих реакций:
Решение. В соответствии с законом действующих масс скорость первой реакции должна быть прямо пропорциональна произведению молярных концентраций NO и О2, взятых в степени равной стехиометрическим коэффициентам:
Для математического выражения скорости второй реакции (гетерогенной системы) учитываются только концентрации газообразных компонентов:
Пример 15. Скорость некоторой реакции увеличивается в 3 раза при повышении температуры реакционной смеси на 10ºС. Во сколько раз увеличится скорость реакции при повышении температуры от 30 до 60ºС?
Решение. По правилу Вант-Гоффа
V(T2)/V(T1) = γ T 2- T 1/10 = 3 60-30/10 = 3 3 = 27
Ответ: Скорость реакции увеличится в 27 раз.
Пример 16. Во сколько раз изменится скорость реакции при понижении температуры от 70 до 40ºС, если температурный коэффициент реакции равен 2?
Решение. По правилу Вант-Гоффа
Ответ: Скорость реакции уменьшится в 8 раз.
Пример 17. Как изменится скорость прямой реакции
если уменьшить объем газовой смеси в три раза.
Решение. Скорость реакции до изменения объема:
При уменьшении объема системы в три раза во столько же раз возрастут концентрации реагирующих веществ (так как концентрация – это масса вещества в единице объема, при постоянной массе с уменьшением объема концентрация веществ возрастает). Тогда после уменьшения объема системы в три раза скорость реакции будет:
Т.е. скорость реакции увеличится в 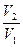
Решение. Согласно уравнению реакции на образование 0,06 моль NO2 расходуется 0,06 моль NO и 0,03 моль О2, следовательно, их равновесные концентрации равны:
[NO] = 0,08 – 0,06 = 0,02 моль/л; [O2] = 0,08-0,03 = 0,05 моль/л.
Подставим эти значения в выражение константы равновесия, получим:
Пример 19. В момент равновесия системы N2 + 3H2 
Решение. Равновесные концентрации реагирующих веществ – это их концентрации в момент химического равновесия. По уравнению реакции из 1 моль N2 образуется 2 моль NH3, следовательно, для нахождения исходной концентрации азота нужно составить пропорцию:
из 1 моль N2 образуется 2 моль NH3;
Таким образом, исходная концентрация азота равна (5 + 3,5) = 8,5 моль/л.
Пример 20. В системе 3А + В 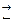
Решение. Концентрация веществ С и D в исходной смеси была равна нулю, то есть все они образовалось в процессе химической реакции. Согласно уравнению реакции, в 1 л равновесной смеси
n(D) = ½ n(C) = ½ × 0,008 = 0,004 (моль).
В процессе реакции исходные концентрации веществ А и В уменьшаются (идет их превращение в продукты реакции). Сравнивая коэффициенты в уравнении реакции, получаем: n(B) = n(D) = 0,004 моль; n(A) = 3×n(B) = 0,012 моль.
Исходные концентрации А и В – это суммы оставшихся и прореагировавших количеств:
| 3 A | + | B | 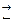 | 2 C | + | D |
| Взято, моль/л | 0,042 | 0,014 | ||||
| К моменту равно-весия прореагиро-вало, моль/л | 0,012 | 0,004 | ||||
| Образовалось, моль/л | 0,008 | 0,004 | ||||
| Осталось, моль/л | 0,030 | 0,010 |
Таким образом, исходная концентрация вещества А – 0,042 моль/л; исходная концентрация вещества В – 0,014 моль/л.
Пример 21. Какие факторы (давление, температура, катализатор) влияют на смещение равновесия в реакции: СО2(г) + С(тв) 
Решение. Рассмотрим по очереди все факторы:
1.Давление. В правой и в левой части уравнения реакции есть газы. Однако V(CO2) = 2V(CO), поэтому по принципу Ле Шателье равновесие сместится в сторону уменьшения давления системы, т.е. влево. Чтобы сместить равновесие вправо, давление следует понизить.
2.Температура. Реакция идет с поглощением тепла. Следовательно, увеличение температуры смещает равновесие вправо.
3.Катализатор во всех случаях ускоряет наступление равновесия, но само равновесие не смещается.
АДСОРБЦИЯ
Адсорбция – это поглощение одного вещества поверхностью другого.
Абсорбция – это поглощение одного вещества в объеме другого.
Нескомпенсированность сил притяжения и отталкивания молекул вещества на поверхности приводит к возникновению поверхностного натяжения и способности к адсорбции молекул из окружающей среды:
По типу взаимодействия молекул поверхности (адсорбента) и молекул окружающей среды (адсорбата) адсорбцию делят на:
1.физическую (связана только с межмолекулярным взаимодействием. Такая адсорбция обратима и всегда сопровождается десорбцией);
2.химическую (сопровождается протеканием на поверхности химической реакции, например, возникновение оксидной пленки на поверхности металлов. Такая адсорбция необратима).
Адсорбция зависит от температуры (уменьшается при нагревании) и от давления (увеличивается при увеличении давления в случае адсорбции из газовой фазы).
Зависимость величины адсорбции от концентрации адсорбата (или давления) при постоянной температуре называется изотермой адсорбции:
Согласно теории Лэнгмюра, адсорбция происходит только в места максимального действия сил притяжения (активные места). Если все активные места поверхности заняты, то адсорбция не происходит. Если считать, что Г – адсорбция в данный момент времени, а Гmax – максимально возможная адсорбция (все активные места адсорбента заняты адсорбатом), то
Г / Гmax = q (степень заполнения поверхности);
1 – q — доля свободной поверхности, способной к адсорбции.
Скорость адсорбции пропорциональна концентрации адсорбата в окружающей среде и количеству свободных мест на поверхности адсорбента (доле свободных мест), а скорость десорбции пропорциональна числу занятых мест на поверхности адсорбента: v(адс.) = k(адс.)×( 1 – q) [адсорбат]
v(дес.) = k(дес.)× q.
При достижении равновесия v(адс.) = v(дес.);
k(адс.)×( 1 – q) [адсорбат] = k(дес.)× q;
k(дес.)/ k(адс.) = q / ( 1 – q) [адсорбат] = К.
Тогда Г = Гmax× K× [адсорбат] / 1 + K× [адсорбат]
В начальный момент адсорбции концентрация адсорбата на поверхности адсорбента мала, то есть 1 >> K× [адсорбат], знаменатель выражения близок к единице, Г = Гmax× K× [адсорбат], то есть адсорбция линейно зависит от концентрации адсорбата (линия 1 на графике).
После того, как все активные места адсорбции заняты, концентрация адсорбата велика, 1
Дата добавления: 2016-11-22 ; просмотров: 2002 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
1.4.3. Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Факторы, влияющие на скорость реакции
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит между твердым веществом и жидкостью или газом перемешивание может ее ускорить.
Задачи с решениями на химическую кинетику и химическое равновесие
Химическая кинетика и химическое равновесие
Задача № 1. Написать математическое выражение скорости прямой и обратной реакций:
Пример 59
Для реакции 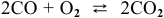
где 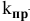
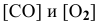
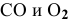
где 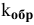
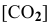
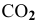
Задача 43
Определить начальную скорость реакции с константой скорости прямой реакции к в растворе, полученном смешением 2 л 0,6 М раствора 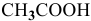
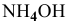
Решение:
Уравнение химической реакции, происходящей в смеси двух растворов, следующее:
Согласно закону действия масс выражение скорости химической реакции
Для определения скорости реакции необходимо знать величину концентраций веществ 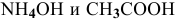
Зная, что в исходном растворе уксусной кислоты содержится 0,6-2 = = 1,2 моль 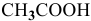
В исходном растворе гидроксида аммония содержится 1-3=3 моль 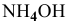
Определяем начальную скорость реакции:
Задача 44
Как изменится скорость прямой реакции
если давление увеличить в 3 раза?
Решение:
Предположим, что в начальный момент до повышения давления концентрации реагирующих веществ следующие:
Скорость реакции, определяемая по закону действия масс, до повышения давления равна:
Согласно уравнению Менделеева-Клапейрона 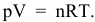
Таким образом, после повышения давления концентрации реагирующих веществ станут равными:
Скорость реакции после повышения давления
Повышение скорости реакции будет следующим:
При повышении давления в 3 раза скорость прямой реакции увеличивается в 27 раз.
Задача 45
Во сколько раз увеличится скорость реакции при увеличении температуры с 50 до 90°С? Температурный коэффициент реакции у равен 2,5.
Решение:
Согласно правилу Вант-Гоффа
Задача 46
Константа скорости реакции разложения HI равна 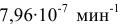
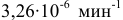
Решение:
Воспользуемся формулой, являющейся производной уравнения Аррениуса:
Теперь, зная энергию активации, можно рассчитать константу скорости реакции при 310 °C:
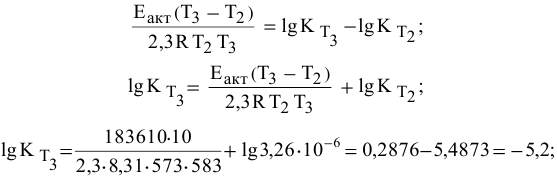
Определяем температурный коэффициент по следующей формуле:
Задача 47
Написать математические выражения констант равновесия следующих реакций:
Решение:
а) Для гомогенной реакции
б) Для гетерогенной реакции
так как концентрации твердых веществ не входят в выражение константы равновесия.
Задача 48
В состоянии равновесия системы 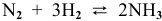
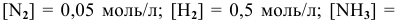
Решение:
Подставим в выражение константы равновесия значения равновесных концентрации:
Задача 49
Константа равновесия реакции 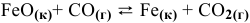

Решение:
Предположим, что в ходе реакции до момента установления состояния химического равновесия концентрация СО уменьшается на X моль/л. Тогда в состоянии химического равновесия концентрации 
Математическое выражение константы равновесия данной реакции:
Отсюда находим значение X:
В состоянии равновесия значения концентрации будут следующими:
Задача 50
Для реакции 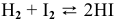
Решение:
Между энергией Гиббса и константой равновесия существует следующая взаимосвязь:
Рассчитываем вначале значение
Находим значение константы равновесия реакции в стандартных условиях 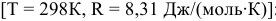
Задача 51
В каком направлении сместится равновесие следующих химических реакций:
если увеличить температуру?
если увеличить концентрацию 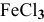
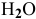
если увеличить давление?
Решение:
Воспользуемся принципом Ле Шателье.
1) Увеличение температуры смещает химическое равновесие в направлении эндотермической реакции, а уменьшение температуры — в направлении экзотермической реакции.
Для реакции 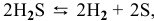
2) Увеличение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, уменьшающей концентрацию этого вещества.
Уменьшение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, увеличивающей концентрацию этого вещества.
Для реакции 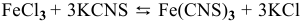
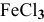
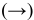
3) Увеличение давления смещает химическое равновесие в направлении реакции, вызывающей уменьшение объема системы, т.е. в сторону реакции с уменьшением числа газообразных молекул.
Для реакции 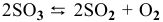


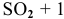
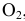
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института