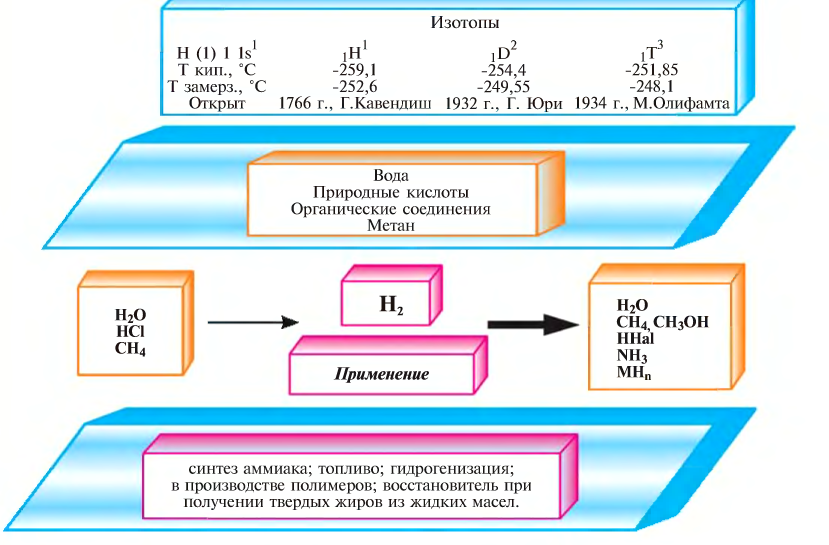
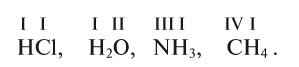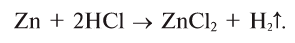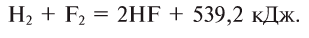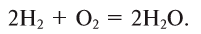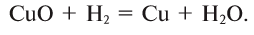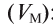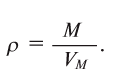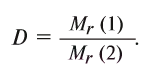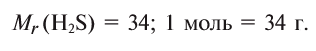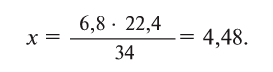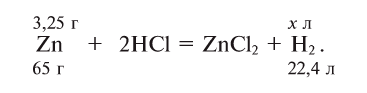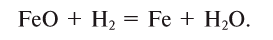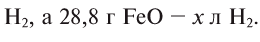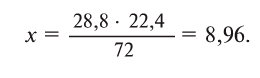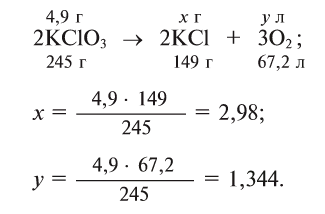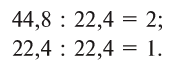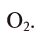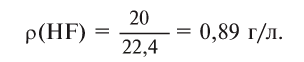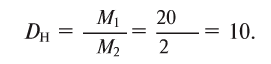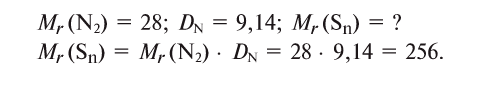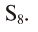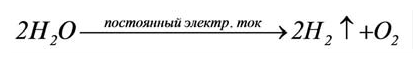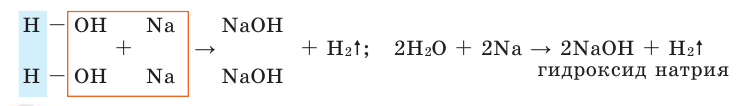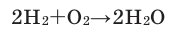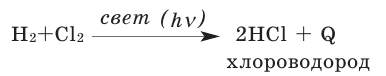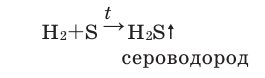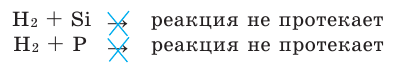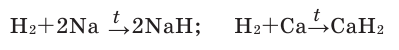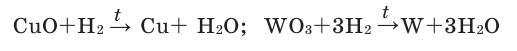Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Соединения водорода
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
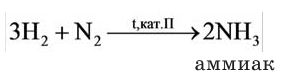
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
2. Водород взаимодействует со сложными веществами:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
Ag + Н2O ≠
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
6. Бинарные соединения неметаллов также гидролизуются водой.
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Содержание:
Водород как химический элемент:
В 1766 г. английский ученый Г. Кавендиш открыл «горючий воздух». В 1783 г. в Париже Ж. Шарлем был запущен шар, заполненный водородом (рис. 25), в 1787 г. А. Лавуазье объяснил, что открытый Г. Кавендишем «горючий воздух» входит в состав воды, и дал ему название «gidrogenium» (Hydrogenium), что означает «рождающий воду». В настоящее время водород обозначается первой буквой этого слова — Н.
В свободном виде водород встречается на Земле в малом количестве.
Он выделяется вместе с другими газами при вулканическом извержении и добыче нефти. Но он широко распространен в виде соединений. Водород — это элемент, образующий наибольшее число соединений. Он составляет 0,88% общей массы земной коры и воздуха. Он составляет 1/9 часть массы молекулы воды, входит в состав всех растительных и животных организмов, нефти, природных газов, ряда минералов.
Определение водорода
Водород — самый распространенный во Вселенной элемент. Он составляет основную часть массы Солнца и других звезд. Водород входит в состав газообразных туманностей, межзвездного газа, звезд во Вселенной, где его атомы превращаются в атомы гелия. Этот процесс происходит с выделением энергии (термоядерная реакция), что служит для многих звезд, в том числе и Солнца, основным источником энергии.
Рис.23 Полет воздушного шара, заполненного водородом. Париж, 1783 г.
Эта энергия необходима для многих природных процессов. Солнечная энергия согревает Землю, приводит в движение воздушные массы атмосферы и воду рек, морей и океанов, обеспечивает процесс фотосинтеза у зеленых растений, наконец, является основным условием для существования жизни.
Водород широко распространен на Земле в виде свободной воды, кристаллизационной воды минералов, метана и углеводородов нефти, различных гидроксидов, растительной и животной биомассы, органического вещества почвы.
Водород и кислоты
Среди соединений водорода, встречающихся в природе, особое место занимают кислоты (кислые воды).
Вспомните услаждающий вкус газированной воды и других прохладительных напитков или сок урюка и кислый вкус ревеня в жаркий летний день. Наверное, каждый знает кисловатый вкус лимона. В природе встречается очень много кислот.
В плодах цитрусовых (лимон, апельсин, мандарин) содержится лимонная кислота, в свежих фруктах (яблоки, айва, фанат) — яблочная кислота, в листьях щавеля и подорожника — щавелевая кислота, в брюшке у муравьев (а также в яде пчел) — муравьиная кислота, в газированной воде содержится угольная кислота.
Многие для приготовления пищи, а особенно печеного, используют уксусную кислоту, которая также применяется для приготовления консервов из овощей. Известно, что уксусную кислоту можно получить брожением винограда или яблок. Если вы будете наблюдать за прокисанием молока, то узнаете, что причиной этого является молочная кислота. В сельской местности готовят силос, в результате чего образуются молочная, масляная и другие кислоты. Для всех вышеназванных кислот характерен кислый вкус, и все они являются соединениями водорода.
Такие вещества, как лакмус, метилоранж, универсальный индикатор, по-разному окрашиваются в растворах кислот: лакмус краснеет, метилоранж становится розовым, универсальный индикатор приобретает красную окраску (рис. 26).
При взаимодействии металлов (магний, цинк, железо, медь) с растворами кислот (неорганических кислот, полученных синтетическим путем) реакция протекает по-разному, в частности, магний вытесняет водород из кислоты быстрее, цинк и железо — медленнее, а медь вообще не вытесняет.
Значит, кислоты — это вещества, которые обладают следующими общими свойствами:
Помимо натуральных есть еще синтетические кислоты, производимые химической промышленностью, которые также являются водородными соединениями. Всем известно, что при желудочно-кишечных расстройствах по указанию врача необходимо принимать слабый раствор соляной кислоты, или то, что серная кислота применяется в аккумуляторных батареях автомобилей.
Кислоты — это сложные вещества, которые обладают некоторыми общими свойствами.
Вещества, меняющие свою окраску в зависимости от специфических свойств соединений, называются индикаторами.
Рис. 26. Влияние растворов кислот на индикаторы
Получение водорода
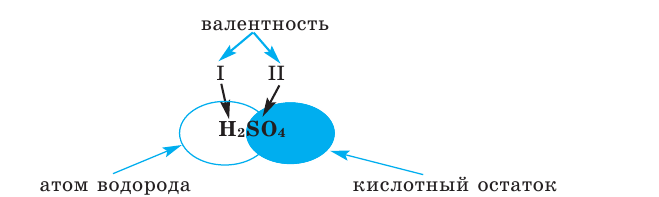
Валентность водорода всегда постоянна и равна 1. Поэтому в соединениях, состоящих из двух элементов (бинарных соединениях), одним из которых является водород, число его атомов показывает валентность другого элемента:
Следовательно, благодаря тому что водород обладает постоянной валентностью, по нему легко определить валентность других элементов.
Рис. 27. Вытеснение водорода цинком из соляной кислоты
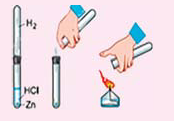
Получение водорода в лаборатории
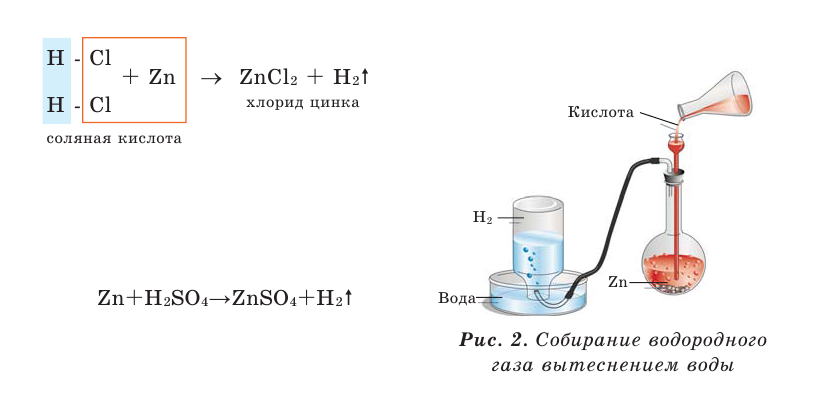
В лаборатории водород получают в результате взаимодействия цинка или железа с соляной кислотой (рис. 27):
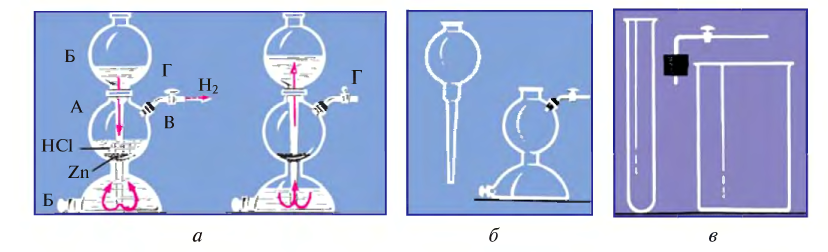
Для этого используют специальную установку или аппарат Киппа (рис. 28).
Аппарат Киппа в любое время готов к работе, которую можно прекратить также в любой момент.
Аппарат состоит из сосуда А и воронки Б и представляет собой соединенные между собой шарообразные и полушарообразные полые резервуары. При установлении воронки Б между ее концом и узкой частью соединения шара и полушара возникает щель. Через тубус В засыпаются кусочки металла такого размера, чтобы они не проходили через шель. В воронку наливается раствор кислоты, который заполняет полушар и достигает, проходя через щель, кусочки металла. Затем подача кислоты прекращается. Между металлом и кислотой протекает реакция, начинает выделяться газ, который выводится наружу посредством газоотводной трубки Г с пробкой, установленной на тубусе. По окончании опыта кран Г закрывается. В результате перекрывается путь для выхода газа. Газ, собираясь, оказывает давление на кислоту, кислота начинает подниматься по воронке, не соприкасаясь с кусочками металла, и в результате реакция прекращается. В шарообразной части сосуда можно хранить водород для его последующего использования.
В случае отсутствия аппарата Киппа из имеющейся в лаборатории посуды можно легко изготовить специальную установку. Принцип ее работы такой же, как и у аппарата Киппа.
Рис. 28. Составные части аппарата Киппа (а); заменяющая его специальная установка (б); работа аппарата Киппа (в)
Получение водорода в промышленности
Водород его формула и молярная масса
Как простое вещество водород состоит из двух атомов 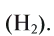
2 г/моль, он является самым легким и хорошо проводящим теплоту газом. При обычных условиях он встречается в атмосфере в небольших количествах. Водород обладает способностью растворяться в металлах. Как самый легкий газ, он обладает самой большой скоростью диффузии. Его молекулы по сравнению с молекулами других газов быстро распределяются в среде соответствующего вещества, легко проходят через различные препятствия. При высоком давлении и температуре эта его способность значительно возрастает.
Химические свойства водорода
При обычной температуре активность молекулярного водорода небольшая, но атомарный водород очень активен.
Водород образует летучие соединения почти со всеми неметаллами. В зависимости от активности неметалла реакция протекает быстро или медленно.
1. Со фтором он взаимодействует уже при комнатной температуре:
2. С хлором вступает в реакцию на свету, а при нагревании взрывается (в темноте и без нагревания соединяется медленно):
3. При обычных условиях с кислородом не взаимодействует. Смесь водорода и кислорода в объемном соотношении 2:1 называется «гремучим газом», который при внешнем воздействии взрывается. Водород горит в кислороде:
При этой реакции температура может достичь 3000°С.
Со многими неметаллами водород вступает в реакцию при высоких температуре и давлении, в присутствии катализаторов (например, с серой и азотом).
1. При высоких температурах водород восстанавливает (вытесняет) металлы из их оксидов:
Атомарный водород при комнатной температуре вступает в реакцию с серой, мышьяком, фосфором, кислородом, восстанавливает металлы из оксидов.
Водород как экологически чистое топливо и его использование
Водород — это топливо будущего, которое при горении образует только воду и не загрязняет окружающую среду, поэтому имеет огромные перспективы в качестве экологически чистого топлива.
Термоядерные реакции превращения водорода в гелий, протекающие на Солнце, являются единственным неисчерпаемым источником энергии для многих природных процессов. Если решится проблема управления этим процессом в искусственных условиях, то человечество будет обладать неиссякаемыми источниками энергии.
Водород используется в большом количестве в химической промышленности для производства аммиака. Основная часть этого аммиака используется для получения удобрений и азотной кислоты. Помимо этого водород расходуется на производство метилового спирта и хлористого водорода (соляной кислоты), гидрогенизацию (насыщение водородом) жиров и масел, угля и нефтепродуктов. При гидрогенизации масел образуется маргарин, а благодаря гидрогенизации угля и нефтепродуктов получают легкое топливо.
Температура водородо-кислородного пламени (
3000°С) позволяет резать и паять тугоплавкие металлы и кварц. Применение водорода в металлургии позволяет получать металлы, хорошо очищенные от оксидов и галогенидов. Жидкий водород используется в технике низких температур, в реактивной технике — как самое высокоэффективное топливо. Водород имеет огромное значение при получении атомной энергии и проведении научных исследований.
Вычисление водорода
В химических реакциях наряду с жидкими и твердыми веществами участвуют и газы. Осуществление расчетов с газообразными веществами происходит обычно в единицах объема
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул. Например, в 22,4 л любого газообразного вещества при 0°С и 101,325 кПа содержится 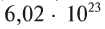
Плотность газа р — это отношение молярной массы газа (М) к его молярному объему
Относительная плотность газов рассчитывается как отношение их молекулярных масс по уравнению:
Вычисление объема газов по уравнениям химических реакций
Пример №1
Какой объем занимают 6,8 г 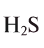
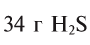
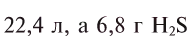
Решая пропорцию, находим:
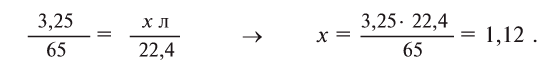
Пример №2
Какой объем водорода при нормальных условиях выделится при растворении 3,25 г цинка в избытке соляной кислоты?
Напишем уравнение реакции и уравняем его:
Составим на основе уравнения реакции пропорцию и решим задачу:
Пример №3
Какой объем водорода необходим для восстановления 28,8 г FeO? Решение:
Составим уравнение реакции:
Из уравнения реакции видно, что на восстановление 1 моля (72 г) FeO нужен 1 моль (22,4 л) водорода.
Для восстановления 72 г FeO необходимо 22,4 л
Пример №4
Для получения кислорода в лабораторных условиях используют термическое разложение бертолетовой соли. Какой объем кислорода и какое количество КС1 образуется из 4,9 г этой соли при нормальных условиях?
Напишем уравнение реакции разложения бертолетовой соли 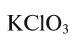
Ответ: 1,344 л 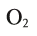
Вычисление объемных соотношений газов по химическим уравнениям
Пример №5
В каком объемном соотношении необходимо взять водород и кислород, чтобы они прореагировали без остатка? Какой объем кислорода вступает в реакцию с 10 л водорода?
1) Напишем уравнение реакции взаимодействия кислорода с водородом:
Из уравнения известно, что 2 моля водорода без остатка реагируют с 1 молем кислорода.
2 моля водорода занимают объем 44,8 л, а 1 моль кислорода — 22,4 л. Объемные соотношения составят:
Следовательно, водород вступает без остатка в реакцию с кислородом при объемных соотношениях, составляющих небольшие целые числа — 2:1, т.е. 2 л водорода без остатка реаг ируют с 1 л кислорода.
2) Найдем объем кислорода, вступающего в реакцию с 10 л водорода. С 2 л водорода взаимодействует 1 л кислорода,
с 10 л — х л. х = 5 л.
Ответ: 2:1; 5л
Вычисление абсолютной и относительной плотности газов
Пример №6
Рассчитайте абсолютную плотность фтористого водорода и его относительную плотность по водороду.
1) Найдем плотность HF.
Молярная масса 1 моля HF — 20 г, а молярный объем — 22,4 л,
2) Найдем относительную плотность HF по
Пример №7
Относительная плотность паров серы по азоту при комнатной температуре равна 9,14. Определите формулу паров серы.
Определим молярную массу паров серы.
Если относительная молекулярная масса паров серы равна 256, то, поделив ее на относительную атомную массу серы — 32, мы получим число атомов в молекуле паров серы, т.е. 256 : 32 = 8.
Значит, формула паров серы —
Распространение водорода в природе и его получение
Влейте в пробирку немного разбавленной серной или соляной кислоты и опустите туда 2-3 кусочка цинка или алюминия. Подождите, когда из пробирки выйдет весь воздух, и потом подожгите полученный водород. Что вы наблюдаете? Запишите уравнение реакции.
Общая характеристика:
Распространение в природе
Впервые водород в чистом виде был получен английским учёным Г.Кавендишем в 1766 году.
Английский ученый. В 1766 году им был получен водород в чистом виде.Ученый вначале принял водород вследствие его легкости за флогистон.
Получение в лаборатории
1) В результате разложения воды под действием электрического тока.
2) В результате вступления в реакцию некоторых металлов (Li, Na, К, Mg, Са, Ва, Al, Zn, Fe) с кислотами (кроме разбавленной и концентрированной 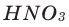
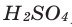
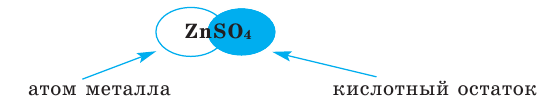
Сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка, называются кислотами. Атомы или группа атомов, соединённых с водородом в молекуле кислоты, называются кислотными остатками.
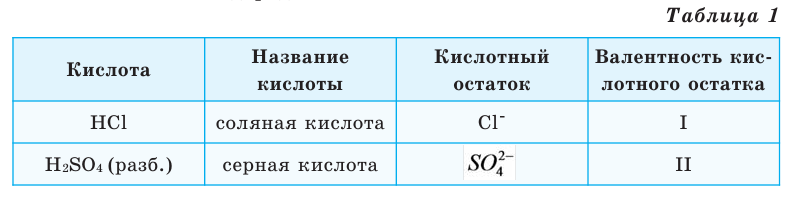
Составим уравнение реакции с металлом цинком (таблица 1).
1 моль любого металла выделяет мольное количество 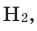
Формулы солей составляются по валентности металла и кислотного остатка. Произношение названий солей основано на названиях металла и кислотного остатка. Например, 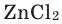
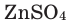
При собирании водорода путём вытеснения воздуха конец газоотводной трубки вставляется в опрокинутый отверстием вниз сосуд (рис. 2).
Для проверки наличия водорода к концу газоотводной трубы подносят небольшую пробирку (на 10-20 секунд), затем, держа ее отверстием вниз, приближают к огню. Раздавшийся при этом взрывоподобный звук или гудение свидетельствуют о наличии водорода
3) В результате реакции активных металлов (Li, Na, К, Са, Ва и др.) с водой. Поскольку эти реакции протекают бурно, а порой и со взрывами, следует брать небольшой кусочек металла, а пробирку, в которой проводится опыт, закрыть воронкой. Во время реакции из молекулы воды вытесняется лишь 1 атом водорода и в результате получается одновалентная гидроксилъная группа (ОН). В свою очередь, гидроксильная группа, соединяясь с атомом металла, образует новое вещество.
Число гидроксильной группы в основаниях зависит от валентности металла.
Полученные в результате этих реакций сложные вещества называются основаниями или гидроксидами. Сложные вещества, состоящие из атома металла и гидроксильной группы, называются основаниями. Названия оснований читаются так: вначале произносится слово «гидроксид», а затем название металла. Если металл имеет переменную валентность, то его валентность отмечается (таблица 3).
Получение в промышленности
Водород в промышленности получают в результате разложения воды под действием постоянного тока:
Другие способы получения водорода в промышленности будут изучены в старших классах.
Свойства и применение водорода
Обратите внимание на картинки. Каким образом на первой картинке шары остаются в воздухе? С какой целью на изображениях шаров на второй картинке даны формулы газов? Поясните свои соображения.
Физические свойства
Химические свойства
При горении водородного газа выделяется большое количество теплоты и температура достигает 3000 
Полученный хлороводород является веществом в газообразном состоянии, его водный раствор называется соляной кислотой.
Если пробирку с расплавленной серой заполнить водородом, то будет ощущаться запах тухлых яиц, свидетельствующий об образовании нового газа — сероводорода:
Широкое применение на практике находит также вещество под названием аммиак 
Водород непосредственно не взаимодействует с неметаллами Si и Р (в том числе и с инертными газами Не, Ne, Ar, Kr, Хе).
Среди металлов бериллий (Be) и алюминий (А1) в непосредственное взаимодействие с водородом не вступают.
Реакции со сложными веществами. Получение ряда металлов в металлургической промышленности основано на реакциях взаимодействия водорода с оксидами данных металлов. При высокой температуре водород притягивает к себе кислород из состава оксидов малоактивных металлов (Zn, Cr, Fe, Cu и др.), вытесняя и выталкивая металлы в свободном состоянии, т.е. он освобождает (восстанавливает) металлы из их оксидов (из-за получения свободного металла масса исходного твёрдого вещества уменьшается).
Применение
Водород считается самым чистым топливом будущего, так как при сгорании он выделяет большое количество тепловой энергии и продуктом его сгорания являются лишь водяные пары, атмосфера при этом не загрязняется. Водород также используется при превращении жидкого масла (растительное масло) в твердое (маргарин), в качестве топлива, при получении, резке и сварке металлов, синтезе аммиака и метанола и др. Применение водорода показано в нижеприведённой схеме. Поскольку водород является самым легким газом, его также используют при наполнении аэростатов (рис. 1).
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.