кальция сульфат
Смотреть что такое «кальция сульфат» в других словарях:
кальция сульфат — kalcio sulfatas statusas T sritis chemija formulė CaSO₄ atitikmenys: angl. calcium sulfate rus. кальций сернокислый; кальция сульфат ryšiai: sinonimas – kalcio tetraoksosulfatas … Chemijos terminų aiškinamasis žodynas
Кальция сульфат — Сульфат кальция (CaSO4) неорганическое соединение, кальциевая соль серной кислоты. Находится в природе в виде дигидрата CaSO4 ∙ 2H2O (гипс, селенит) и в безводном состоянии ангидрит. Безводный сульфат кальция бесцветные кристаллы, плотность… … Википедия
Кальция сульфат — сернокислый кальций, CaSO4, соль. Находится в природе в виде дигидрата CaSO4․2H2O (гипс, селенит) и в безводном состоянии ангидрит. Безводный К. с. бесцветные кристаллы, плотность 2,96 г/см3, tпл 1450°C; очень медленно присоединяет воду.… … Большая советская энциклопедия
КАЛЬЦИЯ СУЛЬФАТ — CaSO4, бесцв. кристаллы; до 1200°С устойчива ромбич. модификация ангидрит ( а =0,699 нм, b= 0,700 нм, с =0,624 нм, z =4, пространств. группа Атта); плотн. 2,98 г/см 3; С°p 99,66 Дж/(моль. К); DH0 обр 1434,5 кДж/моль; S0298 107,00 Дж/(моль … Химическая энциклопедия
КАЛЬЦИЯ СУЛЬФАТ — CaSO4, бесцв. кристаллы. Плохо растворим в воде. Осн. минералы: ангидрит CaSO4 и гипс CaSO4 х 2H2O. Полуобожжёпный гипс CaSO41/2Н2O, будучи замешан с водой, быстро твердеет, превращаясь в CaSO4 х2H2O. Это свойство используют в стр ве, для… … Естествознание. Энциклопедический словарь
КАЛЬЦИЯ СУЛЬФАТ ЖЖЕНЫЙ — Calcii sulfas ustum. Синоним: жженый гипс. Свойства. Сухой мелкий аморфный порошок белого или слегка сероватого цвета. Мало растворим в воде (1:600). Водный раствор имеет нейтральную реакцию. При смешивании с водой (2:1) превращается в однородну … Отечественные ветеринарные препараты
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Сульфат алюминия-калия — Общие Систематическое наименование Сульфат алюминия калия Традиционные названия Сернокислый алюминий калий Химическая формула KAl(SO4)2 Физические свойства Мо … Википедия
Кальция сульфат
Смотреть что такое «Кальция сульфат» в других словарях:
кальция сульфат — CaSO4, бесцветные кристаллы. Плохо растворим в воде. Основные минералы: ангидрит CaSO4 и гипс CaSO4·2Н2O. «Полуобожжённый» гипс CaSO4·1/2Н2O, будучи замешан с водой, быстро твердеет, превращаясь в CaSO4·2H2O. Это свойство используют в… … Энциклопедический словарь
кальция сульфат — kalcio sulfatas statusas T sritis chemija formulė CaSO₄ atitikmenys: angl. calcium sulfate rus. кальций сернокислый; кальция сульфат ryšiai: sinonimas – kalcio tetraoksosulfatas … Chemijos terminų aiškinamasis žodynas
Кальция сульфат — Сульфат кальция (CaSO4) неорганическое соединение, кальциевая соль серной кислоты. Находится в природе в виде дигидрата CaSO4 ∙ 2H2O (гипс, селенит) и в безводном состоянии ангидрит. Безводный сульфат кальция бесцветные кристаллы, плотность… … Википедия
КАЛЬЦИЯ СУЛЬФАТ — CaSO4, бесцв. кристаллы; до 1200°С устойчива ромбич. модификация ангидрит ( а =0,699 нм, b= 0,700 нм, с =0,624 нм, z =4, пространств. группа Атта); плотн. 2,98 г/см 3; С°p 99,66 Дж/(моль. К); DH0 обр 1434,5 кДж/моль; S0298 107,00 Дж/(моль … Химическая энциклопедия
КАЛЬЦИЯ СУЛЬФАТ — CaSO4, бесцв. кристаллы. Плохо растворим в воде. Осн. минералы: ангидрит CaSO4 и гипс CaSO4 х 2H2O. Полуобожжёпный гипс CaSO41/2Н2O, будучи замешан с водой, быстро твердеет, превращаясь в CaSO4 х2H2O. Это свойство используют в стр ве, для… … Естествознание. Энциклопедический словарь
КАЛЬЦИЯ СУЛЬФАТ ЖЖЕНЫЙ — Calcii sulfas ustum. Синоним: жженый гипс. Свойства. Сухой мелкий аморфный порошок белого или слегка сероватого цвета. Мало растворим в воде (1:600). Водный раствор имеет нейтральную реакцию. При смешивании с водой (2:1) превращается в однородну … Отечественные ветеринарные препараты
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Сульфат алюминия-калия — Общие Систематическое наименование Сульфат алюминия калия Традиционные названия Сернокислый алюминий калий Химическая формула KAl(SO4)2 Физические свойства Мо … Википедия
Сульфат кальция: способы получения и химические свойства
Сульфат кальция CaSO4 — соль металла кальция и серной кислоты. Белый. Весьма гигроскопичный. При плавлении разлагается. Мало растворяется в воде.
Относительная молекулярная масса Mr = 136,14; относительная плотность для тв. и ж. состояния d = 2,96; tпл = 1450º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида кальция и сульфата калия при 800º С образуется сульфат кальция и хлорид калия:
2. Сульфат магния взаимодействует с перхлоратом кальция с образованием сульфата кальция и перхлората магния:
3. Гидроксид кальция вступает в реакцию с серной кислотой и образует сульфат кальция и воду:
Качественная реакция
Химические свойства
1. Сульфат кальция реагирует с простыми веществами :
1.1. Сульфат кальция взаимодействует с углеродом (коксом) при 900º С и образует сульфид кальция, угарный газ или углекислый газ:
CaSO4 + 4C = CaS + 4CO
2. Сульфат кальция вступает в реакцию со многими сложными веществами :
2.1. Сульфат кальция взаимодействует с оксидами :
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид кальция и углекислый газ:
CaSO4 + 4CO = CaS + 4CO2
2.2. Сульфат кальция может реагировать с кислотами :
2.2.1. При взаимодействии с концентрированной серной кислотой сульфат кальция образует гидросульфат кальция:
2.3. Сульфат кальция реагирует с солями :
3. Сульфат кальция разлагается при температуре выше 1450º С, образуя оксид кальция, оксид серы и кислород:
Сульфат кальция
| Сульфат кальция | |
|---|---|
 | |
| Систематическое наименование | Сульфат кальция |
| Традиционные названия | кальций сернокислый, «ангидрит» |
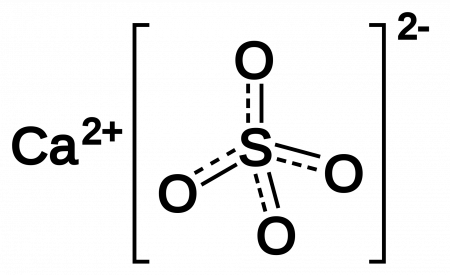
| Хим. формула | CaSO4 |
| Состояние | кристаллическое |
| Молярная масса | 136,1406 г/моль |
| Плотность | 2,96 г/см³ |
| Температура | |
| • плавления | 1450°C (с частичным разложением) |
| • разложения | 1560°C |
| Мол. теплоёмк. | 99.660 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1434,5 кДж/моль |
| Удельная теплота плавления | 28 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,2036 г/100 мл воды |
| ГОСТ | ГОСТ 3210-77 ГОСТ 31108-2203 |
| Рег. номер CAS | 7778-18-9 |
| PubChem | 24497 |
| Рег. номер EINECS | 231-900-3 |
| SMILES | |
| Кодекс Алиментариус | E516 |
| RTECS | WS6920000 |
| ChEBI | 31346 |
| ChemSpider | 22905 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
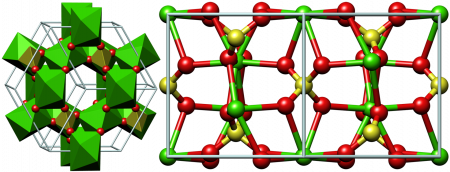
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4•2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Содержание
Физические свойства
Безводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2O и CaSO4 · 2H2O. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
Физические свойства двуводного сульфата кальция
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO 4 · 2H2O = CaSO4 · 0,5H2O + 1,5H2O.
Получение
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
Может быть получен действием серной кислоты на оксид, гидроксид, карбонат, оксалат или ацетат кальция. Образуется в результате окисления сульфида кальция при нагреве до 700—800 °C по реакции CaS + 2O2 = CaSO4.
Применение
Значительные объёмы алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.».
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Также находит применение в пиротехнике в качестве окислителя в осветительных составах, в смеси с алюминием или магнием в отношении гипс алюминий 1:1
2 в зависимости от требований. Используется как в порошкообразном так и в отверженном состоянии.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
В пищевой промышленности зарегистрирован в качестве пищевой добавки эмульгатора E516.
Регистрационный номер CAS:
Сульфат кальция
Сульфат кальция (пищевая добавка Е516) — неорганическое соединение, кальциевая соль серной кислоты с химической формулой CaSO4. Пищевая добавка Е516 относится к эмульгаторам, улучшителям муки и хлеба, комплексообразователям и отвердителям искусственного происхождения, используется в технологических целях в процессе производства пищевых продуктов. Внешне выглядит как мелкий порошок без запаха от белого до слабого жёлто-белого цвета. Температура плавления 1450 °C (с разложением); средне растворим в воде; нерастворим в этаноле.
В природе встречается в виде дигидрата CaSO4•2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Получение
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
В аналитической химии может быть получен воздействием серной кислоты на оксид, гидроксид, карбонат, оксалат или ацетат кальция.
Образуется в результате окисления сульфида кальция при нагреве до 700–800 °C по реакции CaS + 2O2 = CaSO4.
Применение
Пищевая добавка
В виноделии для подкисления сусла, для предотвращения размягчения консервированных томатов, целых или порезанных на кубики или ломтики. Является также питанием для дрожжей. Иногда применяется в производстве творога для ускорения и облегчения формирования плотного, хор. отделяющего сыворотку сгустка. В пивоварении используется для регулирования кислотности затора.
Другие сферы применения
Значительные объёмы алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.».
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Так же находит применение в пиротехнике в качестве окислителя в осветительных составах, в смеси с алюминием или магнием в отношении гипс алюминий 1:1
2 в зависимости от требований. Используется как в порошкообразном так и в отверженном состоянии.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
Польза и вред
Сульфат кальция легко усваивается, безопасен для здоровья. Является источником кальция. Кальций — жизненно важный минеральный элемент, необходимый для поддержания равновесия электролитов в организме и адекватного функционирования многочисленных регуляторных механизмов. Принимает участие в обмене костной ткани, регулирует процесс возбудимости и сократимости в миокарде, поперечнополосатой и гладкой мускулатуре, участвует в процессах возбуждения центральной и периферической нервной системы, регуляции свёртываемости крови, проницательности сосудистой стенки и активности ферментов.
Беременность и грудное вскармливание
Применение при беременности
Адекватных и хорошо контролируемых исследований о возможности применения сульфата кальция у беременных женщин не проведено.
Применение в период грудного вскармливания
Специальных исследований о возможности применения сульфата кальция в период грудного вскармливания не проведено.
Особые указания
В Российской Федерации, Евросоюзе, на Украине и в большинстве стран мира пищевая добавка Е516 разрешена для применения в пищевой промышленности.