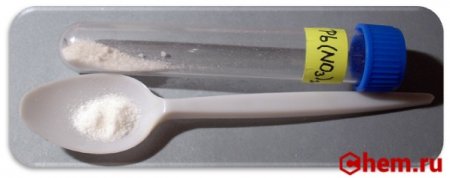
Нитрат свинца(II)
| Динитрат свинца | |
 | |
 | |
  | |
| Общие | |
|---|---|
| Систематическое наименование | нитрат свинца(II) |
| Химическая формула | Pb(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветное вещество |
| Молярная масса | 331.2 г/моль |
| Плотность | (20 °C) 4,53 г/см³ |
| Термические свойства | |
| Температура плавления | (разл.) 270 °C |
| Температура вспышки | негорюч °C |
| Химические свойства | |
| Растворимость в воде | (20 °C) 52 г/100мл |
Нитрат свинца(II) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Хорошо растворим в воде.
Содержание
История
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
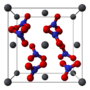
Кристаллическая структура
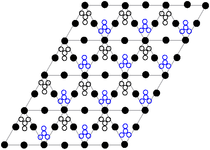
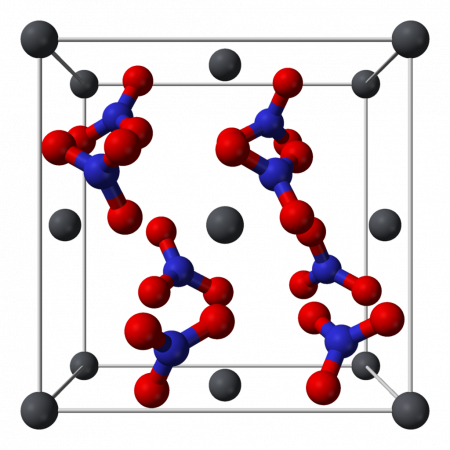
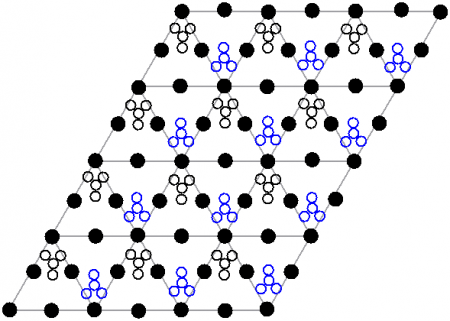
Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:


кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
Химические свойства
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Так как только динитрат и ацетат свинца(II) являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:



Любое соединение, содержащее катион свинца(II), будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-желтого цвета (иодид свинца(II)). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь [11] :
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступе, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
При нагревании кристаллов динитрата свинца они начинают разлагаться на диоксид свинца, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Меры предосторожности
Нитрат свинца II
| Нитрат свинца | |||
|---|---|---|---|
| |||
| Систематическое наименование | нитрат свинца II | ||
| Хим. формула | Pb(NO3)2 | ||
| Состояние | бесцветное вещество | ||
| Молярная масса | 331.2 г/моль | ||
| Плотность | (20 °C) 4,53 г/см³ | ||
| Температура | |||
| • плавления | (разл.) 270 °C | ||
| • вспышки | негорюч °C | ||
| Растворимость | |||
| • в воде | (20 °C) 52 г/100мл (100 °C) 127 г/100 мл | ||
| • в остальных веществах | в азотной кислоте, этаноле: нерастворим | ||
| Показатель преломления | 1.782 | ||
| Координационная геометрия | кубооктаэдрическая | ||
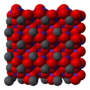
| Кристаллическая структура | гранецентрированная кубическая | ||
| Рег. номер CAS | 10099-74-8 | ||
| PubChem | 16683880 | ||
| Рег. номер EINECS | 233-245-9 | ||
| SMILES | |||
| RTECS | OG2100000 | ||
| ChEBI | 37187 | ||
| Номер ООН | 1469 | ||
| ChemSpider | 23300 и 21781774 | ||
| Пиктограммы ECB |    | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Нитрат свинца II (Свинец азотнокислый) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде.
Содержание
История
Исторически первое промышленное применение нитрата свинца II — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца II), «хром оранжевый» (гидроксид-хромат свинца II) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий.
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса.
Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны.
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
Кристаллическая структура
Кристаллическая структура твердого динитрата свинца была определена с помощью нейтронной дифракции. Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решетке при высоких температурах, но это не подтвердилось.
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота.
Химические свойства
Динитрат свинца хорошо растворяется в воде, давая бесцветный раствор. Растворимость сильно увеличивается при нагревании:
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Так как только динитрат и ацетат свинца II являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
Любое соединение, содержащее катион свинца II, будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-жёлтого цвета (йодид свинца II). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь:
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступке, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например, Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
При нагревании кристаллов динитрата свинца они начинают разлагаться на оксид свинца II, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике.
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца II начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота).
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов. Он также нашёл применение для получения изотиоцианатов из дитиокарбаматов. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции.
Меры предосторожности
Динитрат свинца токсичен и канцерогенен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца.
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase ) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери.
Нитрат свинца: состав, свойства, получение, применение.
Содержание:
Он обладает сильными окислительными свойствами, поэтому его используют там, где это требуется, например, при получении различных органических соединений и в качестве лабораторного реагента.
В прошлом он широко использовался для приготовления красок на основе свинца, где он также действовал как закрепитель цвета в тканях. От этого приложения отказались из-за токсичности свинца.
Он использовался в металлургической промышленности по-разному, и недавно было обнаружено, что он полезен для образования вместе с другими соединениями материалов с высокой способностью поглощать свет и превращать его в электричество.
Однако это опасное вещество, поскольку оно может способствовать возникновению пожаров. Он также токсичен для людей, животных и растений, поэтому его нельзя выбрасывать в окружающую среду.
Состав
Свинец в этом соединении имеет следующую электронную конфигурацию:
Номенклатура
Свойства
Физическое состояние
Белое или бесцветное кристаллическое твердое вещество. Кубические кристаллы.
Молекулярный вес
Температура плавления
470 ° С. По некоторым данным, при этой температуре он разлагается.
Плотность
Растворимость
Хорошо растворим в воде: 59,7 г / 100 мл воды при 25 ° C. Слабо растворим в этаноле. Нерастворим в азотной кислоте (HNO3) концентрированный.
pH
Водный раствор с 20% Pb (NO3)2 он имеет pH 3,0-4,0.
Химические свойства
Это окислитель. Реагирует бурно с горючими материалами и восстановителями.
Он не горюч, но может ускорить горение материалов. При нагревании до разложения выделяет токсичные газы оксида азота:
При растворении в воде ионизирует:
Получение
Его можно получить путем реакции металлического свинца, монооксида свинца (PbO) или карбоната свинца PbCO.3 с азотной кислотой. Желательно использовать избыток кислоты, чтобы избежать образования основных нитратов.
Приложения
В органическом синтезе
Его окислительная способность находит применение при получении различных соединений.
Он был использован для синтеза каликсаренов, которые представляют собой органические соединения, молекула которых имеет форму корзины, которая позволяет вмещать другие вещества в зависимости от того, как они будут использоваться.
Он используется для получения изотиоцианатов (R-NCS), исходя из аминов (R-NH2).
Он используется в промышленных масштабах для получения бензальдегида путем окисления бензилхлорида. Он также служит катализатором этерификации органических соединений, например, при производстве сложных полиэфиров.
В химическом анализе
Он используется как реагент при определении алюминия и свинца в минералах и горных породах.
При окраске текстильных волокон
Некоторые хромовые красители требуют использования Pb (NO3)2 чтобы получить это. Например, чтобы окрасить хлопок в желтый цвет, хлопок покрывают нитратом свинца и обрабатывают сульфатом натрия для получения сульфата свинца.
Затем наносят разбавленный раствор дихромата натрия для образования хромата свинца (PbCrO4), который представляет собой желтый пигмент.
Однако в настоящее время производство свинцовых пигментов прекращено из-за их токсичности.
Он также действует как протрава для фиксации красителей во время окрашивания или печати других типов волокон.
В ветеринарной медине
Ранее он использовался как едкое средство при лечении язвы или гангрены у лошадей.
В металлургической промышленности
Нитрат свинца используется при электролитическом рафинировании свинца в качестве агента, способствующего флотации при удалении титана из определенных глин, он позволяет извлекать драгоценные металлы из цианидных растворов и используется при электроосаждении PbO.2 на никелевых анодах.
В солнечных батареях
Он использовался в виде водного раствора для изготовления солнечных элементов на основе перовскита, минерала оксида титана.
Синтезированный материал представляет собой металлоорганический перовскит или перовскит из иодида свинца, который привлек внимание исследователей, так как обладает высокой способностью поглощать свет и большой длиной диффузии носителей заряда.
Эти характеристики делают его отличным кандидатом для фотоэлектрических устройств, которые преобразуют свет в электрический ток.
Другие приложения
Риски
Пожар и взрыв
Хотя это не горючий состав, при воздействии огня или тепла он может взорваться, образуя токсичные оксиды азота.
Поскольку это сильно окислитель, существует опасность возгорания при контакте с органическими материалами.
На здоровье
Вызывает раздражение глаз, дыхательных путей и пищеварительного тракта. Он токсичен при вдыхании и проглатывании. Наиболее частыми симптомами интоксикации этим соединением являются желудочно-кишечные расстройства, колики, запоры и слабость, которые, в частности, могут перерасти в паралич некоторых мышц.
Для окружающей среды
Он токсичен для водных и наземных организмов, кроме того, его повреждения являются стойкими, и он биоаккумулируется в живых существах, поэтому считается опасным загрязнителем и не должен выбрасываться в окружающую среду.
При случайном попадании в воду его необходимо нейтрализовать оксидом кальция (CaO), карбонатом кальция (CaCO3) или бикарбонат натрия (NaHCO3).
Было подтверждено, что он канцерогенный для животных и, возможно, для человека.
Ссылки
Что такое делитель напряжения? (с примерами)
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется нитрат свинца, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Как пишется нитрат свинца", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.